Влияние дезоксирибонуклеата натрия с железом комплекса на экспрессию поверхностных маркеров клеток МТ-4, инфицированных вирусом иммунодефицита человека 1-го типа (ВИЧ-1) (Retroviridae: Primate lentivirus group)
- Авторы: Носик Д.Н.1, Калнина Л.Б.1, Селимова Л.М.1, Каплина Э.Н.2
-
Учреждения:
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- ООО «ФармПак»
- Выпуск: Том 69, № 4 (2024)
- Страницы: 309-319
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://journal-vniispk.ru/0507-4088/article/view/265949
- DOI: https://doi.org/10.36233/0507-4088-240
- EDN: https://elibrary.ru/uzlpzs
- ID: 265949
Цитировать
Аннотация
Введение. Cохранение иммунной дисфункции при терапии имеет серьезные последствия для здоровья ВИЧ-инфицированных пациентов. Поэтому важным направлением является поиск препаратов, способных снижать воспалительный потенциал иммунной системы и служащих дополнительным компонентом противовирусных лекарств.
Цель работы – изучить влияние иммуномодулирующего препарата дезоксирибонуклеата натрия с железом комплекс (ДНК-Na-Fe) на экспрессию маркеров активации в клетках линии МТ-4, зараженных ВИЧ-1.
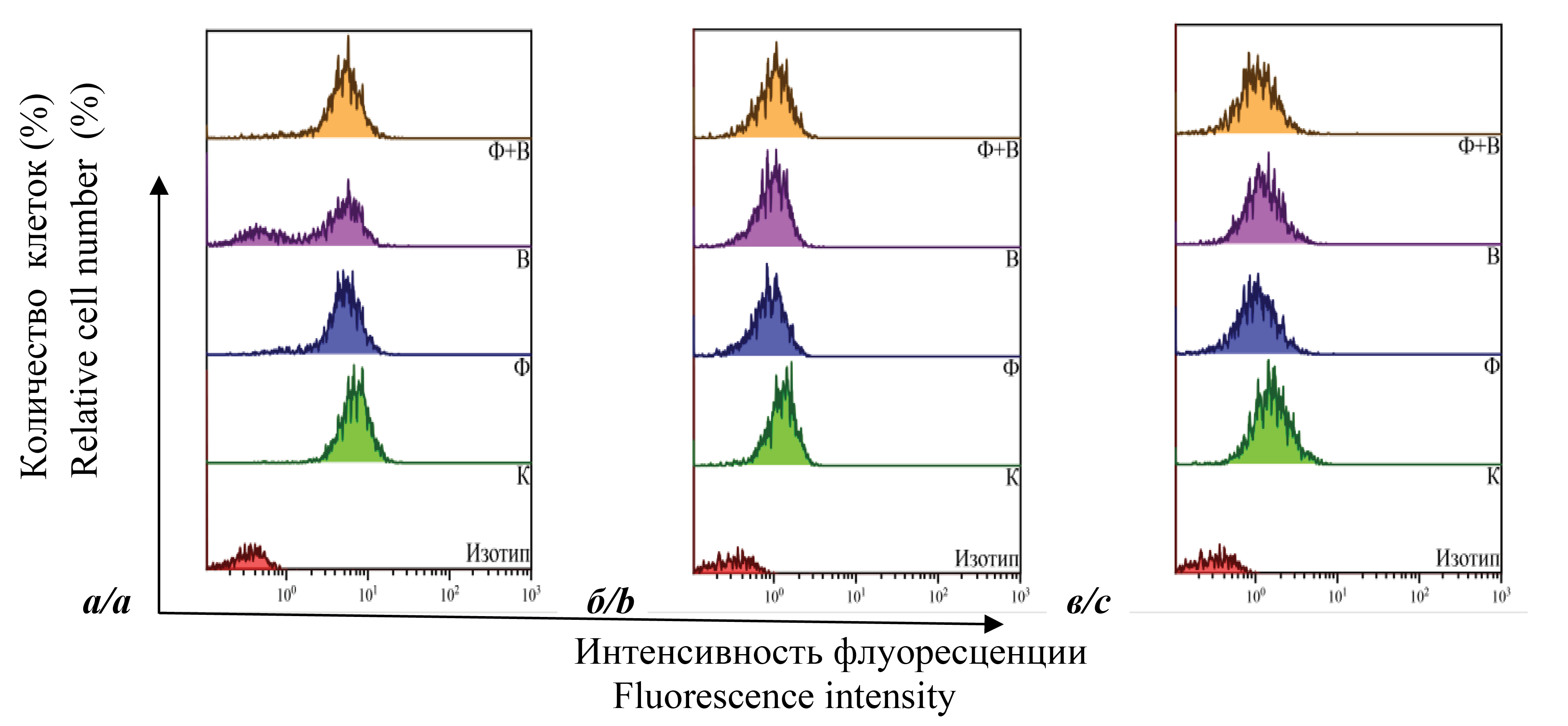
Материалы и методы. В клетках определяли уровни экспрессии на плазматической мембране белков CD4, CD28, CD38, CD62L и HLA-DR. Для оценки вирусной активности определяли количество белка p24 методом иммуноферментного анализа.
Результаты и обсуждение. При изучении экспрессии поверхностных маркеров проанализировали 2 варианта клеточных линий с разной репликативной активностью. Тестировали контрольные клетки, клетки, культивируемые в присутствии ДНК-Na-Fe, зараженные клетки и зараженные клетки, культивируемые в присутствии ДНК-Na-Fe. На основании полученных результатов можно сделать вывод о том, что противовирусная активность препарата при заражении МТ-4-клеток ВИЧ-1 связана с иммуномодулирующей активностью, изменяющей экспрессию мембранных белков CD4, CD28, CD38 и CD62L. Наблюдаемое разнообразие во влиянии ДНК-Na-Fe на экспрессию изученных поверхностных белков в двух линиях клеток, указывает на то, что оно зависит от особенностей совокупных молекулярно-биологических процессов, происходящих в клетках. А усиление эффектов, наблюдаемых в клетках с повышенной репликативной активностью, предполагает активное участие ДНК-Na-Fe в репликации вируса на стадиях проникновения и почкования.
Заключение. Исследования показали, что ДНК-Na-Fe обладает противовирусной и иммуномодулирующей активностью.
Полный текст
Открыть статью на сайте журналаОб авторах
Дмитрий Николаевич Носик
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: dnnosik@yandex.ru
ORCID iD: 0000-0001-5757-5671
д-р мед. наук, профессор, руководитель лаборатории противовирусных и дезинфекционных средств Института вирусологии имени Д.И. Ивановского
Россия, 123098, г. МоскваЛюдмила Борисовна Калнина
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: klb3@yandex.ru
ORCID iD: 0000-0002-2702-8578
канд. биол. наук, ведущий научный сотрудник лаборатории противовирусных и дезинфекционных средств Института вирусологии имени Д.И. Ивановского
Россия, 123098, г. МоскваЛюдмила Мидатовна Селимова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: lselim@mail.ru
ORCID iD: 0000-0003-3709-770X
д-р биол. наук, ведущий научный сотрудник лаборатории противовирусных и дезинфекционных средств Института вирусологии им. Д.И. Ивановского
Россия, 123098, г. МоскваЭлли Николаевна Каплина
ООО «ФармПак»
Email: info@derinat.ru
ORCID iD: 0000-0001-8540-5856
канд. тех. наук, профессор РАЕ, консультант
Россия, 105318, г. МоскваСписок литературы
- Masenga S.K., Mweene B.C., Luwaya E., Muchaili L., Chona M., Kirabo A. HIV-host cell interactions. Cells. 2023; 12(10): 1351. https://doi.org/10.3390/cells12101351
- Hokello J., Tyagi P., Dimri S., Sharma A.L., Tyagi M. Comparison of the biological basis for non-HIV transmission to HIV-exposed seronegative individuals, disease non-progression in HIV long-term non-progressors and elite controllers. Viruses. 2023; 15(6): 1362. https://doi.org/10.3390/v15061362
- Ventura J.D. Human Immunodeficiency Virus 1 (HIV-1): Viral latency, the reservoir, and the cure. Yale J. Biol. Med. 2020; 93(4): 549–60.
- Lv T., Cao W., Li T. HIV-related immune activation and inflammation: current understanding and strategies. J. Immunol. Res. 2021; 2021: 7316456. https://doi.org/10.1155/2021/7316456
- Yang X., Su B., Zhang X., Liu Y., Wu H., Zhang T. Incomplete immune reconstitution in HIV/AIDS patients on antiretroviral therapy: Challenges of immunological non-responders. J. Leukoc. Biol. 2020; 107(4): 597–612. https://doi.org/10.1002/JLB.4MR1019-189R
- Беседнова Н.Н., Макаренкова И.Д., Федянина Л.Н., Авдеева Ж.И., Крыжановский С.П., Кузнецова Т.А. и др. Дезоксирибонуклеиновая кислота про- и эукариот в профилактике и терапии инфекционных болезней. Антибиотики и химиотерапия. 2018; 63(5-6): 52–67. https://elibrary.ru/xvvinv
- Носик Д.Н., Калнина Л.Б., Лобач О.А., Чатаева М.С., Бережная Е.В., Бочкова М.С. и др. Противовирусная и вирулицидная активность дезоксирибонуклеата натрия и его комплекса с железом в отношении вирусов разных царств и семейств. Вопросы вирусологии. 2022; 67(6): 506–15. https://doi.org/10.36233/0507-4088-148 https://elibrary.ru/rtrade
- Miyoshi I., Kubonishi I., Yoshimoto S., Akagi T., Ohtsuki Y., Shiraishi Y., et al. Type C virus particles in a cord T-cell line derived by co-cultivating normal human cord leukocytes and human leukaemic T cells. Nature. 1981; 294(5843): 770–1. https://doi.org/10.1038/294770a0
- Селимова Л.М., Калнина Л.Б., Носик Д.Н. Поверхностные маркёры неопластической клеточной линии МТ-4 и перспективы её использования в качестве модели для изучения активности иммуномодулирующих препаратов. Клиническая лабораторная диагностика. 2016; 61(12): 822–5. https://doi.org/10.18821/0869-2084-2016-61-12-822-825 https://elibrary.ru/xscfqz
- Носик Д.Н., Калнина Л.Б., Селимова Л.М., Пронин А.В. Увеличение инфекционности вируса иммунодефицита человека при модификации гена ccr5 чувствительных клеток. Доклады Российской Академии наук. Науки о жизни. 2023; 511(1): 344–8. https://doi.org/10.31857/S2686738923700257 https://elibrary.ru/jiltbd
- Levesque K., Finzi A., Binette J., Cohen E.A. Role of CD4 receptor down-regulation during HIV-1 infection. Curr. HIV Res. 2004; 2(1): 51–9. https://doi.org/10.2174/1570162043485086
- Boomer J.S., Green J.M. An enigmatic tail of CD28 signaling. Cold Spring Harb. Perspect. Biol. 2010; 2(8): a002436. https://doi.org/10.1101/cshperspect.a002436
- Nandi D., Pathak S., Verma T., Singh M., Chattopadhyay A., Thakur S., et al. T cell costimulation, checkpoint inhibitors and anti-tumor therapy. J. Biosci. 2020; 45: 50.
- Leonard J.A., Filzen T., Carter C.C., Schaefer M., Collins K.L. HIV-1 Nef disrupts intracellular trafficking of major histocompatibility complex class I, CD4, CD8, and CD28 by distinct pathways that share common elements. J. Virol. 2011; 85(14): 6867–81. https://doi.org/10.1128/JVI.00229-11
- Rohr J., Guo S., Huo J., Bouska A., Lachel C., Li Y., et al. Recurrent activating mutations of CD28 in peripheral T-cell lymphomas. Leukemia. 2016; 30(5): 1062–70. https://doi.org/10.1038/leu.2015.357
- Glaría E., Valledor A.F. Roles of CD38 in the Immune Response to Infection. Cells. 2020; 9(1): 228. https://doi.org/10.3390/cells9010228
- Savarino A., Bottarel F., Malavasi F., Dianzani U. Role of CD38 in HIV-1 infection: an epiphenomenon of T-cell activation or an active player in virus/host interactions? AIDS. 2000; 14(9): 1079–89. https://doi.org/10.1097/00002030-200006160-00004
- Vassena L., Giuliani E., Koppensteiner H., Bolduan S., Schindler M., Doria M. HIV-1 Nef and Vpu interfere with L-selectin (CD62L) cell surface expression to inhibit adhesion and signaling in infected CD4+ T lymphocytes. J. Virol. 2015; 89(10): 5687–700. https://doi.org/10.1128/JVI.00611-15
- Segura J., He B., Ireland J., Zou Z., Shen T., Roth G., et al. The role of L-selectin in HIV infection. Front. Microbiol. 2021; 12: 725741. https://doi.org/10.3389/fmicb.2021.725741
- Freedman A.S., Nadler L.M. Immunologic markers in non-Hodgkin’s lymphoma. Hematol. Oncol. Clin. North Am. 1991; 5(5): 871–89.
- Mahalingam M., Pozniak A., McManus T.J., Vergani D., Peakman M. Cell cycling in HIV infection: analysis of in vivo activated lymphocytes. Clin. Exp. Immunol. 1995; 102(3): 481–6. https://doi.org/10.1111/j.1365-2249.1995.tb03841.x
- Horsburgh B.A., Lee E., Hiener B., Eden J.S., Schlub T.E., von Stockenstrom S., et al. High levels of genetically intact HIV in HLA-DR+ memory T cells indicates their value for reservoir studies. AIDS. 2020; 34(5): 659–68. https://doi.org/10.1097/qad.0000000000002465
Дополнительные файлы