Endothelial protective properties of sacubitril-valsartan and drotaverine in influenza A(H1N1)pdm09 virus infection (Orthomyxoviridae: Alphainfluenzavirus: influenza A virus)
- 作者: Marchenko V.A.1, Zelinskaya I.A.2, Mukhametdinova D.V.2, Toropova Y.G.2, Galagudza M.M.2, Zhilinskaya I.N.1
-
隶属关系:
- North-Western State Medical University Named after I.I. Mechnikov
- V.A. Almazov National Medical Research Centre, Russian Ministry of Health
- 期: 卷 70, 编号 4 (2025)
- 页面: 349-362
- 栏目: ORIGINAL RESEARCH
- URL: https://journal-vniispk.ru/0507-4088/article/view/330073
- DOI: https://doi.org/10.36233/0507-4088-235
- EDN: https://elibrary.ru/amzvmr
- ID: 330073
如何引用文章
全文:
详细
Introduction. Severe influenza is characterized by damage and morphofunctional changes of the endothelium of blood vessels, which contributes to the development of hemorrhagic syndrome and can cause endothelial dysfunction. To optimize the pathogenetic therapy of influenza infection, a screening of medications with endothelial protective properties was carried out.
Aim. The aim of the study was to evaluate the endothelial protective properties of sacubitril/valsartan and drotaverine in influenza A(H1N1)pdm09 virus infection.
Materials and methods. The study was conducted on Wistar rats, which received sacubitril/valsartan and drotaverine (in treatment and prophylactic regimen) followed by intransal infection with influenza A/Saint-Petersburg/48/16 (H1N1)pdm09 virus. Rats without drug administration were included in the control group; rats received no medications followed by influenza virus infection – in challenge control group. The virus infectious activity was determined in pulmonary and mesenteric tissues. Vascular endothelium damage in lungs was assessed by three parameters (desquamation, morphological and dystrophic changes). Endothelial nitric oxide synthase (eNOS) expression level in endothelium of mesenteric blood vessels was determined as well as mesenteric arteries vasomotor activity.
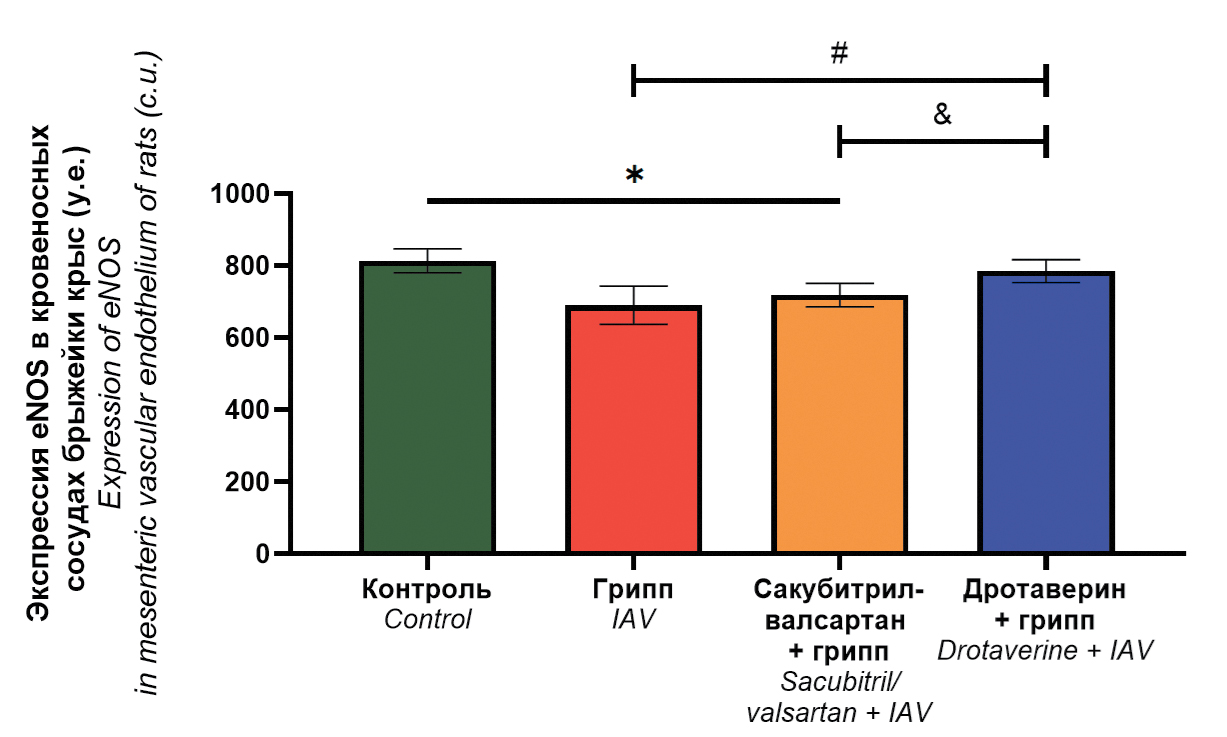
Results. Drotaverine reduces the severity of histopathological changes in the pulmonary vascular endothelium; increases the maximal response of mesenteric blood vessels to acetylcholine compared to the infection control group; normalizes eNOS expression levels. Sacubitril/valsartan reduces the severity of desquamation in the pulmonary vascular endothelium; normalizes the response of mesenteric blood vessels to acetylcholine, while eNOS expression is decreased.
Conclusions. Drotaverine possesses more significant endothelial protective properties than sacubitril/valsartan when used in a treatment and prophylactic regimen in rats infected with influenza A(H1N1)pdm09 virus.
作者简介
Vladimir Marchenko
North-Western State Medical University Named after I.I. Mechnikov
编辑信件的主要联系方式.
Email: vmarcenco@mail.ru
ORCID iD: 0000-0001-6870-3157
Ph. D. in medicine, Associate Professor of Medical Microbiology Department
俄罗斯联邦, 191015, St. PetersburgIrina Zelinskaya
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: irina.selinskaja@gmail.com
ORCID iD: 0000-0002-1971-3444
Researcher of Laboratory of Bioprosthetics and Cardiac Protection, Institute of Experimental Medicine
俄罗斯联邦, 197341, St. PetersburgDarya Mukhametdinova
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: mukh.dv@yandex.ru
ORCID iD: 0000-0002-7109-1187
Research Assistant of Experimental Pathomorphology Group, Institute of Experimental Medicine
俄罗斯联邦, 197341, St. PetersburgYana Toropova
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: yana.toropova@mail.ru
ORCID iD: 0000-0003-1629-7868
Sc. D., Head of Laboratory of Bioprosthetics and Cardiac Protection, Institute of Experimental Medicine
俄罗斯联邦, 197341, St. PetersburgMichael Galagudza
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: galagoudza@mail.ru
ORCID iD: 0000-0001-5129-9944
MD, Sc. D., Professor and Corresponding member of the Russian Academy of Sciences, Director of the Institute of Experimental Medicine
俄罗斯联邦, 197341, St. PetersburgIrina Zhilinskaya
North-Western State Medical University Named after I.I. Mechnikov
Email: s_zhilinskaya@mail.ru
ORCID iD: 0000-0002-0084-1323
Sc. D., Professor of Medical Microbiology Department
俄罗斯联邦, 191015, St. Petersburg参考
- WHO. Global Influenza Strategy 2019–2030; 2019. Available at: https://apo.org.au/node/224416
- Tenforde M.W., Noah K.P., O’Halloran A.C., Kirley P.D., Hoover C., Alden N.B., et al. Timing of influenza antiviral therapy and risk of death in adults hospitalized with influenza-associated pneumonia, influenza hospitalization surveillance network (FluSurv-NET), 2012–2019. Clin. Infect. Dis. 2025; 80(2): 461–8. https://doi.org/10.1093/cid/ciae427
- Lampejo T. Influenza and antiviral resistance: an overview. Eur. J. Clin. Microbiol. Infect. Dis. 2020; 39(7): 1201–8. doi: 10.1007/s10096-020-03840-9
- Fage C., Loison S., Zwygart A.C., Poli R., Rosset S., Medaglia C., et al. Influenza A(H1N1)pdm09 virus resistance to baloxavir, oseltamivir and sialic acid mimetics in single and dual therapies: Insights from human airway epithelia and murine models. Antiviral. Res. 2025; 239: 106174. https://doi.org/10.1016/j.antiviral.2025.106174
- Barber H. A case of influenzal myocarditis. Clin J. 1947; 76(5): 181–3.
- Skaarup K.G., Modin D., Nielsen L., Jensen J.U.S., Biering-Sørensen T. Influenza and cardiovascular disease pathophysiology: strings attached. Eur. Heart J. Suppl. 2023; 25(Suppl. A): A5–11. https://doi.org/10.1093/eurheartjsupp/suac117
- Jeyanathan T., Overgaard C., McGeer A. Cardiac complications of influenza infection in 3 adults. CMAJ. 2013; 185(7): 581–4. https://doi.org/10.1503/cmaj.110807
- Goldsteyn E.M. Influenza-associated mortality for circulatory and respiratory causes during the 2013-2014 through the 2018-2019 influenza seasons in Russia. Mezhdunarodnyi zhurnal prikladnykh i fundamental’nykh issledovanii. 2019; (12): 9–16. https://doi.org/10.17513/mjpfi.12945 https://elibrary.ru/dhthqt (in Russian)
- Cioffi D.L., Pandey S., Alvarez D.F., Cioffi E.A. Terminal sialic acids are an important determinant of pulmonary endothelial barrier integrity. Am. J. Physiol. Lung. Cell Mol. Physiol. 2012; 302(10): L1067–77. https://doi.org/10.1152/ajplung.00190.2011
- Vlasov T.D., Petrischev N.N., Lazovskaya O.A. Endothelial dysfunction. Do we understand this term properly? Vestnik anesteziologii i reanimatologii. 2020; 17(2): 76–84. https://doi.org/10.21292/2078-5658-2020-17-2-76-84 https://elibrary.ru/eqepoi (in Russian)
- Marchenko V.A., Zhilinskaya I.N. Endothelial activation and dysfunction caused by influenza A virus (Alphainfluenzavirus influenzae). Voprosy virusologii. 2024; 69(6): 465–78. https://doi.org/10.36233/0507-4088-264 https://elibrary.ru/zujoza (in Russian)
- Loscalzo J., Welch G. Nitric oxide and its role in the cardiovascular system. Prog. Cardiovasc. Dis. 1995; 38(2): 87–104. https://doi.org/10.1016/s0033-0620(05)80001-5
- Marchenko V.A., Barashkova S.V., Zelinskaya I.A., Toropova Ya.G., Ramsay E.S., Zhilinskaya I.N. Modulation of endothelial factors activity in human endothelial cells in influenza A(H1N1)pdm09 virus infection. Voprosy virusologii. 2021; 66(3): 198–210. https://doi.org/10.36233/0507-4088-48 https://elibrary.ru/wsxlvb (in Russian)
- Marchenko V.A., Zelinskaya I.A., Toropova Ya.G., Mukhametdinova D.V., Galagudza M.M., Lioznov D.A., et al. Duration of systemic alteration in vasomotor function of microvascular endothelium caused by the influenza A(H1N1)pdm09 virus. Regionarnoe krovoobrashchenie i mikrotsirkulyatsiya. 2023; 22(4): 74–86. https://doi.org/10.24884/1682-6655-2023-22-4-74-86 https://elibrary.ru/mmwnsf (in Russian)
- Roganova I.V. Comparative characteristics of cerebral circulation dysfunction in different age groups of patients with influenza virus infection. Izvestiya vysshikh uchebnykh zavedenii. Povolzhskii region. Meditsinskie nauki. 2011; (1): 108–15. https://elibrary.ru/oetuod (in Russian)
- Boytsov S.A. Influenza, novel Coronavirus infection and cardiovascular diseases. Kardiologicheskii vestnik. 2021; 16(1): 5–9. https://doi.org/10.17116/Cardiobulletin2021160115 https://elibrary.ru/zgvxkg (in Russian)
- Choudhary A., Rawat U., Kumar P., Mittal P. Pleotropic effects of statins: the dilemma of wider utilization of statin. Egypt. Heart J. 2023; 75(1): 1. https://doi.org/10.1186/s43044-023-00327-8
- Radigan K.A., Urich D., Misharin A.V., Chiarella S.E., Soberanes S., Gonzalez A., et al. The effect of rosuvastatin in a murine model of influenza A infection. PLoS One. 2012; 7(4): e35788. https://doi.org/10.1371/journal.pone.0035788
- Wu F., Wang C., Li S., Ye Y., Cui M., Liu Y., et al. Association between statins administration and influenza susceptibility: a systematic review and meta-analysis of longitudinal studies. Viruses. 2024; 16(2): 278. https://doi.org/10.3390/v16020278
- Caldeira D., Alarcão J., Vaz-Carneiro A., Costa J. Risk of pneumonia associated with use of angiotensin converting enzyme inhibitors and angiotensin receptor blockers: systematic review and meta-analysis. BMJ. 2012; 345: e4260. https://doi.org/10.1136/bmj.e4260
- Henry C., Zaizafoun M., Stock E., Ghamande S., Arroliga A.C., White H.D. Impact of angiotensin-converting enzyme inhibitors and statins on viral pneumonia. Proc. (Bayl. Univ. Med. Cent.). 2018; 31(4): 419–23. https://doi.org/10.1080/08998280.2018.1499293
- Sribhutorn A., Phrommintikul A., Wongcharoen W., Chaikledkaew U., Eakanunkul S., Sukonthasarn A. The modification effect of influenza vaccine on prognostic indicators for cardiovascular events after acute coronary syndrome: observations from an influenza vaccination trial. Cardiol. Res. Pract. 2016; 2016: 4097471. https://doi.org/10.1155/2016/4097471
- Marchenko V., Zelinskaya I., Toropova Y., Shmakova T., Podyacheva E., Lioznov D., et al. Influenza A virus causes histopathological changes and impairment in functional activity of blood vessels in different vascular beds. Viruses. 2022; 14(2): 396. https://doi.org/10.3390/v14020396
- Marchenko V., Mukhametdinova D., Amosova I., Lioznov D., Zhilinskaya I. Influenza A(H1N1)pdm09 virus alters expression of endothelial factors in pulmonary vascular endothelium in rats. Viruses. 2022; 14(11): 2518. https://doi.org/10.3390/v14112518
- Mazza A., Townsend D.M., Torin G., Schiavon L., Camerotto A., Rigatelli G., et al. The role of sacubitril/valsartan in the treatment of chronic heart failure with reduced ejection fraction in hypertensive patients with comorbidities: From clinical trials to real-world settings. Biomed. Pharmacother. 2020; 130: 110596. https://doi.org/10.1016/j.biopha.2020.110596
- Cassano V., Armentaro G., Magurno M., Aiello V., Borrello F., Miceli S., et al. Short-term effect of sacubitril/valsartan on endothelial dysfunction and arterial stiffness in patients with chronic heart failure. Front. Pharmacol. 2022; 13: 1069828. https://doi.org/10.3389/fphar.2022.1069828
- Hellmann M., Dąbrowska E., Żarczyńska-Buchowiecka M., Romanowska-Kocejko M., Narkiewicz K., Gruchała M., et al. Sacubitril/valsartan improved microvascular endothelial function in a young patient with COVID-19-related mild left ventricular dysfunction. Kardiol. Pol. 2022; 80(5): 614–5. https://doi.org/10.33963/kp.a2022.0063
- Ramakrishnan M.A. Determination of 50 % endpoint titer using a simple formula. World J. Virol. 2016; 5(2): 85–6. https://doi.org/10.5501/wjv.v5.i2.85
- Taylor C.R., Levenson R.M. Quantification of immunohistochemistry-issues concerning methods, utility and semiquantitative assessment II. Histopathology. 2006; 49(4): 411–24. https://doi.org/10.1111/j.1365-2559.2006.02513.x
- Marchenko V.A., Barashkova S.V., Zelinskaya I.A., Toropova Y.G., Sorokin E.V., Zhilinskaya I.N. Modeling influenza virus infection in mature Wistar rats. Voprosy virusologii. 2020; 65(3): 159–66. https://doi.org/10.36233/0507-4088-2020-65-3-159-166 https://elibrary.ru/ufdacp (in Russian)
- Janaszak-Jasiecka A., Siekierzycka A., Płoska A., Dobrucki I.T., Kalinowski L. Endothelial dysfunction driven by hypoxia – the influence of oxygen deficiency on no bioavailability. Biomolecules. 2021; 11(7): 982. https://doi.org/10.3390/biom11070982
- Zhang C. The role of inflammatory cytokines in endothelial dysfunction. Basic Res. Cardiol. 2008; 103(5): 398–406. https://doi.org/10.1007/s00395-008-0733-0
- Shaito A., Aramouni K., Assaf R., Parenti A., Orekhov A., Yazbi A.E., et al. Oxidative stress-induced endothelial dysfunction in cardiovascular diseases. Front. Biosci. (Landmark Ed). 2022; 27(3): 105. https://doi.org/10.31083/j.fbl2703105
补充文件