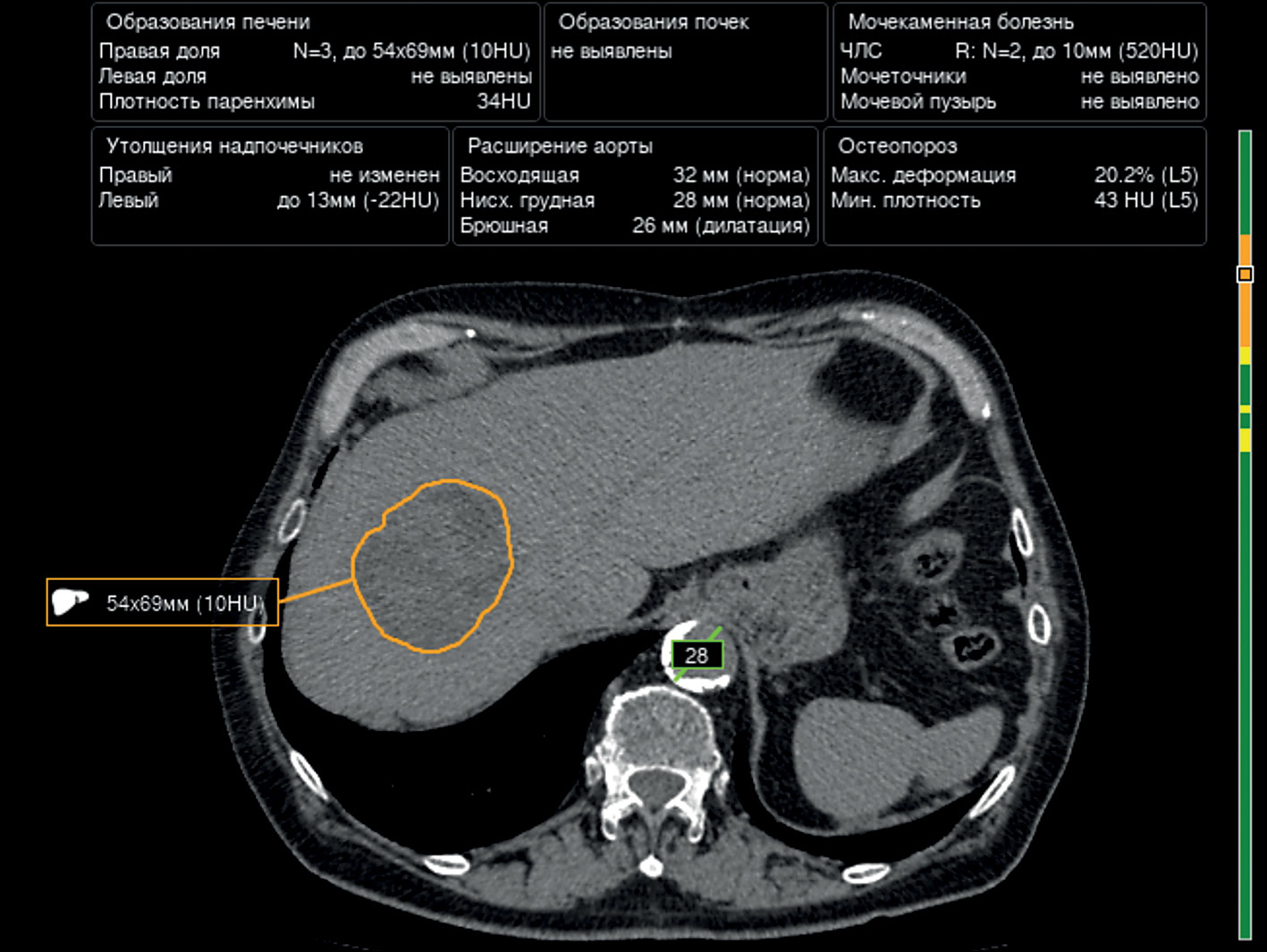
Перспективы применения компьютерного зрения для выявления камней в мочевыделительной системе и новообразований печени и почек на изображениях компьютерной томографии органов брюшной полости и забрюшинного пространства
- Авторы: Васильев Ю.А.1,2, Владзимирский А.В.1,3, Арзамасов К.М.1, Шихмурадов Д.У.1, Панкратов А.В.1, Ульянов И.В.1, Нечаев Н.Б.1
-
Учреждения:
- Научно-практический клинический центр диагностики и телемедицинских технологий
- Национальный медико-хирургический Центр имени Н.И. Пирогова
- Первый Московский государственный медицинский университет имени И.М. Сеченова
- Выпуск: Том 5, № 1 (2024)
- Страницы: 101-119
- Раздел: Обзоры
- URL: https://journal-vniispk.ru/DD/article/view/262980
- DOI: https://doi.org/10.17816/DD515814
- ID: 262980
Цитировать
Аннотация
В работе представлен селективный обзор литературы, посвящённый использованию алгоритмов компьютерного зрения для диагностики новообразований печени и почек, а также камней в мочевыделительной системе на изображениях компьютерной томографии органов брюшной полости и забрюшинного пространства.
В обзор были включены статьи, опубликованные за период с 01.01.2020 по 24.04.2023 гг.
В задаче сегментации печени и её новообразований алгоритмы, оперирующие пикселями, показали наибольшие значения параметров диагностической точности (точность достигает 99,6%; коэффициент сходства Дайса — 0,99). Задачи классификации новообразований печени на текущий момент лучше решаются воксельными алгоритмами (точность до 82,5%).
Сегментация почек и их новообразований, а также классификация опухолей почек одинаково хорошо выполняются алгоритмами, анализирующими как пиксели, так и воксели (точность достигает 99,3%, коэффициент сходства Дайса — 0,97).
Алгоритмы компьютерного зрения в настоящее время также способны с высокой степенью точности определять конкременты в мочевыделительной системе размерами от 3 мм (точность достигает 93,0%).
Таким образом, существующие алгоритмы компьютерного зрения позволяют не только эффективно выявлять новообразования печени и почек, а также конкременты в мочевыделительной системе, но и с высокой точностью определять их количественные и качественные характеристики.
Более высокая точность определения вида новообразования может быть достигнута за счёт оценки воксельных данных, поскольку в этом случае алгоритм анализирует новообразование полностью в трёх измерениях, а не только в плоскости одного среза.
Полный текст
Открыть статью на сайте журналаОб авторах
Юрий Александрович Васильев
Научно-практический клинический центр диагностики и телемедицинских технологий; Национальный медико-хирургический Центр имени Н.И. Пирогова
Email: npcmr@zdrav.mos.ru
ORCID iD: 0000-0002-0208-5218
SPIN-код: 4458-5608
канд. мед. наук
Россия, Москва; МоскваАнтон Вячеславович Владзимирский
Научно-практический клинический центр диагностики и телемедицинских технологий; Первый Московский государственный медицинский университет имени И.М. Сеченова
Email: VladzimirskijAV@zdrav.mos.ru
ORCID iD: 0000-0002-2990-7736
SPIN-код: 3602-7120
д-р мед. наук, профессор
Россия, Москва; МоскваКирилл Михайлович Арзамасов
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: ArzamasovKM@zdrav.mos.ru
ORCID iD: 0000-0001-7786-0349
SPIN-код: 3160-8062
канд. мед. наук
Россия, МоскваДавид Уружбегович Шихмурадов
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: ShikhmuradovDU@zdrav.mos.ru
ORCID iD: 0000-0003-1597-5786
SPIN-код: 9641-0913
MD
Россия, МоскваАндрей Вячеславович Панкратов
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: PankratovAV3@zdrav.mos.ru
ORCID iD: 0009-0008-4741-4530
MD
Россия, МоскваИлья Владимирович Ульянов
Научно-практический клинический центр диагностики и телемедицинских технологий
Email: UlyanovIV2@zdrav.mos.ru
ORCID iD: 0000-0002-8330-6069
SPIN-код: 5898-3242
MD
Россия, МоскваНиколай Борисович Нечаев
Научно-практический клинический центр диагностики и телемедицинских технологий
Автор, ответственный за переписку.
Email: NechaevNB@zdrav.mos.ru
ORCID iD: 0009-0007-9219-7726
SPIN-код: 3232-1545
канд. мед. наук
Россия, МоскваСписок литературы
- Ильяшенко О.Ю., Лукьянченко Е.Л. Возможности применения компьютерного зрения для аналитики данных в медицине // Известия Саратовского университета. Новая серия. Серия : Математика. Механика. Информатика. 2022. Т. 22, № 2. С. 224–232. EDN: MCSLKQ doi: 10.18500/1816-9791-2022-22-2-224-232
- Алексеева М.Г., Зубов А.И., Новиков М.Ю. Искусственный интеллект в медицине // Международный научно-исследовательский журнал. 2022. Т. 7, № 121. C. 10–13. EDN: JMMMDF doi: 10.23670/IRJ.2022.121.7.038
- Гусев А.В., Владзимирский А.В., Шарова Д.Е., Арзамасов К.М., Храмов А.Е. Развитие исследований и разработок в сфере технологий искусственного интеллекта для здравоохранения в Российской Федерации: итоги 2021 года // Digital Diagnostics. 2022. Т. 3, № 3. C. 178–194. EDN: KHWQWZ doi: 10.17816/DD107367
- Wang L., Wang H., Huang Y., et al. Trends in the application of deep learning networks in medical image analysis: Evolution between 2012 and 2020 // Eur J Radiol. 2022. Vol. 146. P. 110069. doi: 10.1016/j.ejrad.2021.110069
- Alrefai N., Ibrahim O. AI Deep learning-based cancer classification for microarray data: A systematic review // Journal of Theoretical and Applied Information Technology. 2021. Vol. 99. P. 2312–2332. doi: 10.5281/zenodo.6126510
- Клинические испытания систем искусственного интеллекта (лучевая диагностика) / под ред. Ю.А. Васильева, А.В. Владзимирского, Д.Е. Шаровой, и др. Москва : ГБУЗ «НПКЦ ДиТ ДЗМ», 2023. EDN: PUIJLD
- Lee J., Kim K.W., Kim S.Y., et al. Automatic detection method of hepatocellular carcinomas using the non-rigid registration method of multi-phase liver CT images // J Xray Sci Technol. 2015. Vol. 23, N 3. P. 275–288. doi: 10.3233/XST-150487
- Patel B.N., Boltyenkov A.T., Martinez M.G., et al. Cost-effectiveness of dual-energy CT versus multiphasic single-energy CT and MRI for characterization of incidental indeterminate renal lesions // Abdom Radiol (NY). 2020. Vol. 45, N 6. P. 1896–1906. doi: 10.1007/s00261-019-02380-x
- Marrero J.A., Kulik L.M., Sirlin C.B., et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases // Hepatology. 2018. Vol. 68, N 2. P. 723–750. doi: 10.1002/hep.29913
- Ayuso C., Rimola J., Vilana R., et al. Diagnosis and staging of hepatocellular carcinoma (HCC): current guidelines // Eur J Radiol. 2018. Vol. 101. P. 72–81. doi: 10.1016/j.ejrad.2018.01.025
- Клинические рекомендации — Рак печени (гепатоцеллюлярный). ID 1. Одобрено Научно-практическим Советом Минздрава РФ. 2022. Режим доступа: https://cr.minzdrav.gov.ru/schema/1_3 Дата обращения: 03.04.2023
- Rahman H., Bukht T.F.N., Imran A., et al. A Deep Learning Approach for Liver and Tumor Segmentation in CT Images Using ResUNet // Bioengineering (Basel). 2022. Vol. 9, N 8. P. 368. doi: 10.3390/bioengineering9080368
- Maqsood M., Bukhari M., Ali Z., et al. A Residual-Learning-Based Multi-Scale Parallel-Convolutions- Assisted Efficient CAD System for Liver Tumor Detection // Mathematics. 2021. Vol. 9, N 10. P. 1133. doi: 10.3390/math9101133
- Khan R.A., Luo Y., Wu F.X. RMS-UNet: Residual multi-scale UNet for liver and lesion segmentation // Artif Intell Med. 2022. Vol. 124. P. 102231. doi: 10.1016/j.artmed.2021.102231
- Affane A., Kucharski A., Chapuis P., et al. Segmentation of Liver Anatomy by Combining 3D U-Net Approaches // Applied Sciences. 2021. Vol. 11, N 11. P. 4895. doi: 10.3390/app11114895
- Han X., Wu X., Wang S., et al. Automated segmentation of liver segment on portal venous phase MR images using a 3D convolutional neural network // Insights Imaging. 2022. Vol. 13, N 1. P. 26. doi: 10.1186/s13244-022-01163-1
- Wang J., Zhang X., Guo L., et al. Multi-scale attention and deep supervision-based 3D UNet for automatic liver segmentation from CT // Math Biosci Eng. 2023. Vol. 20, N 1. P. 1297–1316. doi: 10.3934/mbe.2023059
- Kashala K.G., Song Y., Liu Z. Optimization of FireNet for Liver Lesion Classification // Electronics. 2020. Vol. 9, N 8. P. 1237. doi: 10.3390/electronics9081237
- Trivizakis E., Manikis G.C., Nikiforaki K., et al. Extending 2-D Convolutional Neural Networks to 3-D for Advancing Deep Learning Cancer Classification With Application to MRI Liver Tumor Differentiation // IEEE J Biomed Health Inform. 2019. Vol. 23, N 3. P. 923–930. doi: 10.1109/JBHI.2018.2886276
- Zhou J., Wang W., Lei B., et al. Automatic Detection and Classification of Focal Liver Lesions Based on Deep Convolutional Neural Networks: A Preliminary Study // Front Oncol. 2021. Vol. 10. P. 581210. doi: 10.3389/fonc.2020.581210
- Rela M., Rao S.N., Patil R.R. Performance analysis of liver tumor classification using machine learning algorithms // International Journal of Advanced Technology and Engineering Exploration. 2022. Vol. 9, N 86. P. 143–154. doi: 10.19101/IJATEE.2021.87465
- Oberai A., Varghese B., Cen S., et al. Deep learning based classification of solid lipid-poor contrast enhancing renal masses using contrast enhanced CT // Br J Radiol. 2020. Vol. 93, N 1111. P. 20200002. doi: 10.1259/bjr.20200002
- Lin Z., Cui Y., Liu J., et al. Automated segmentation of kidney and renal mass and automated detection of renal mass in CT urography using 3D U-Net-based deep convolutional neural network // Eur Radiol. 2021. Vol. 31, N 7. P. 5021–5031. doi: 10.1007/s00330-020-07608-9
- Toda N., Hashimoto M., Arita Y., et al. Deep Learning Algorithm for Fully Automated Detection of Small (≤4 cm) Renal Cell Carcinoma in Contrast-Enhanced Computed Tomography Using a Multicenter Database // Invest Radiol. 2022. Vol. 57, N 5. P. 327–333. doi: 10.1097/RLI.0000000000000842
- Ding Y., Chen Z., Wang Z., et al. Three-dimensional deep neural network for automatic delineation of cervical cancer in planning computed tomography images // J Appl Clin Med Phys. 2022. Vol. 23, N 4. P. e13566. doi: 10.1002/acm2.13566
- Zhu X.L., Shen H.B., Sun H., et al. Improving segmentation and classification of renal tumors in small sample 3D CT images using transfer learning with convolutional neural networks // Int J Comput Assist Radiol Surg. 2022. Vol. 17, N 7. P. 1303–1311. doi: 10.1007/s11548-022-02587-2
- Hsiao C.H., Sun T.L., Lin P.C., et al. A deep learning-based precision volume calculation approach for kidney and tumor segmentation on computed tomography images // Comput Methods Programs Biomed. 2022. Vol. 221. P. 106861. doi: 10.1016/j.cmpb.2022.106861
- Hsiao C.H., Lin P.C., Chung L.A., et al. A deep learning-based precision and automatic kidney segmentation system using efficient feature pyramid networks in computed tomography images // Comput Methods Programs Biomed. 2022. Vol. 221. P. 106854. doi: 10.1016/j.cmpb.2022.106854
- Islam M.N., Hasan M., Hossain M.K., et al. Vision transformer and explainable transfer learning models for auto detection of kidney cyst, stone and tumor from CT-radiography // Sci Rep. 2022. Vol. 12, N 1. P. 11440. doi: 10.1038/s41598-022-15634-4
- Yang L., Gao L., Arefan D., et al. A CT-based radiomics model for predicting renal capsule invasion in renal cell carcinoma // BMC Med Imaging. 2022. Vol. 22, N 1. P. 15. doi: 10.1186/s12880-022-00741-5
- Shehata M., Alksas A., Abouelkheir R.T., et al. A Comprehensive Computer-Assisted Diagnosis System for Early Assessment of Renal Cancer Tumors // Sensors (Basel). 2021. Vol. 21, N 14. P. 4928. doi: 10.3390/s21144928
- Куликовский В.Ф., Шкодкин С.В., Батищев С.А., и др. Современные представления о эпидемиологии и патогенезе уролитиаза // Научный результат. Медицина и фармация. 2016. Т. 2, № 4. С. 4–12. EDN: NSGAXL doi: 10.18413/2313-8955-2016-2-4-4-12
- Gadzhiev N., Prosyannikov M., Malkhasyan V., et al. Urolithiasis prevalence in the Russian Federation: analysis of trends over a 15-year period // World J Urol. 2021.Vol. 39, N 10. P. 3939–3944. doi: 10.1007/s00345-021-03729-y
- Урология. Российские клинические рекомендации / под ред. Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря. Москва : ГЭОТАРМедиа, 2016.
- Caglayan A., Horsanali M.O., Kocadurdu K., et al. Deep learning model-assisted detection of kidney stones on computed tomography // Int Braz J Urol. 2022. Vol. 48, N 5. P. 830–839. doi: 10.1590/S1677-5538.IBJU.2022.0132
- Elton D.C., Turkbey E.B., Pickhardt P.J., Summers R.M. A deep learning system for automated kidney stone detection and volumetric segmentation on noncontrast CT scans // Med Phys. 2022. Vol. 49, N 4. P. 2545–2554. doi: 10.1002/mp.15518
- He Z., An L., Chang Z., Wu W. Comment on “Deep learning computer vision algorithm for detecting kidney stone composition” // World J Urol. 2021. Vol. 39, N 1. P. 291. doi: 10.1007/s00345-020-03181-4
- Doyle P.W., Kavoussi N.L. Machine learning applications to enhance patient specific care for urologic surgery // World J Urol. 2022. Vol. 40, N 3. P. 679–686. doi: 10.1007/s00345-021-03738-x
- Neymark A.I., Neymark B.A., Ershov A.V., et al. The use of intelligent analysis (IA) in determining the tactics of treating patients with nephrolithiasis // Urologia Journal. 2023. N 3915603231162881. doi: 10.1177/03915603231162881
- Kadlec A.O., Ohlander S., Hotaling J., et al. Nonlinear logistic regression model for outcomes after endourologic procedures: a novel predictor // Urolithiasis. 2014. Vol. 42, N 4. P. 323–330. doi: 10.1007/s00240-014-0656-1
- Black K.M., Law H., Aldoukhi A., et al. Deep learning computer vision algorithm for detecting kidney stone composition // BJU Int. 2020. Vol. 125, N 6. P. 920–924. doi: 10.1111/bju.15035
- Zhang G.M., Sun H., Xue H.D., et al. Prospective prediction of the major component of urinary stone composition with dual-source dual-energy CT in vivo // Clin Radiol. 2016. Vol. 71, N 11. P. 1178–1183. doi: 10.1016/j.crad.2016.07.012
- Chaytor R.J., Rajbabu K., Jones P.A., McKnight L. Determining the composition of urinary tract calculi using stone-targeted dual-energy CT: evaluation of a low-dose scanning protocol in a clinical environment // Br J Radiol. 2016. Vol. 89, N 1067. P. 20160408. doi: 10.1259/bjr.20160408
- Капанадзе Л.Б., Серова Н.С., Руденко В.И. Аспекты применения двухэнергетической компьютерной томографии в диагностике мочекаменной болезни // REJR. 2017. Т. 7, № 3. С. 165–173. EDN: ZWBLYL doi: 10.21569/2222-7415-2017-7-3-165-173
- Cui Y., Sun Z., Ma S., et al. Automatic Detection and Scoring of Kidney Stones on Noncontrast CT Images Using S.T.O.N.E. Nephrolithometry: Combined Deep Learning and Thresholding Methods // Mol Imaging Biol. 2021. Vol. 23, N 3. P. 436–445. doi: 10.1007/s11307-020-01554-0
- Okhunov Z., Friedlander J.I., George A.K., et al. S.T.O.N.E. nephrolithometry: novel surgical classification system for kidney calculi // Urology. 2013. Vol. 81, N 6. P. 1154–1159. doi: 10.1016/j.urology.2012.10.083
- Yildirim K., Bozdag P.G., Talo M., et al. Deep learning model for automated kidney stone detection using coronal CT images // Comput Biol Med. 2021. Vol. 135. P. 104569. doi: 10.1016/j.compbiomed.2021.104569
- Коденко М.Р., Решетников Р.В., Макарова Т.А. Инструмент оценки качества исследований диагностической точности алгоритмов искусственного интеллекта (QUADAS-CAD) // Digital Diagnostics. 2022. Т. 3, № 1S. C. 4–5. EDN: KNBHOJ doi: 10.17816/DD105567
- Schwartz F.R., Clark D.P., Ding Y., Ramirez-Giraldo J.C. Evaluating renal lesions using deep-learning based extension of dual-energy FoV in dual-source CT-A retrospective pilot study // Eur J Radiol. 2021. Vol. 139. P. 109734. doi: 10.1016/j.ejrad.2021.109734
- Li W., Diao K., Wen Y., et al. High-strength deep learning image reconstruction in coronary CT angiography at 70-kVp tube voltage significantly improves image quality and reduces both radiation and contrast doses // Eur Radiol. 2022. Vol. 32, N 5. P. 2912–2920. doi: 10.1007/s00330-021-08424-5
- Bae J.S., Lee J.M., Kim S.W., et al. Low-contrast-dose liver CT using low monoenergetic images with deep learning-based denoising for assessing hepatocellular carcinoma: a randomized controlled noninferiority trial // Eur Radiol. 2023. Vol. 33, N 6. P. 4344–4354. doi: 10.1007/s00330-022-09298-x
Дополнительные файлы