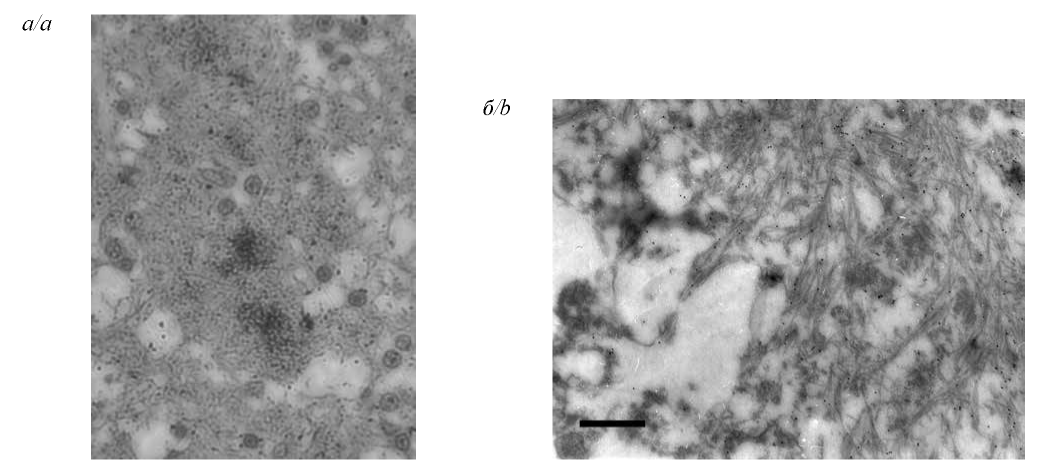
Problems of ante mortem diagnostics of prion diseases
- Authors: Kal’nov S.L.1, Verkhovsky O.A.2, Tsibezov V.V.1, Alekseev K.P.1, Chudakova D.A.3, Filatov I.E.1, Grebennikova T.V.1
-
Affiliations:
- FSBI «National Research Centre of Epidemiology and Microbiology named after honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
- ANO «Diagnostic and Prevention for Human and Animal Diseases Research Institute»
- School of Biological sciences, University of Auckland
- Issue: Vol 65, No 6 (2020)
- Pages: 326-334
- Section: REVIEWS
- URL: https://journal-vniispk.ru/0507-4088/article/view/118135
- DOI: https://doi.org/10.36233/0507-4088-2020-65-6-3
- ID: 118135
Cite item
Full Text
Abstract
The review presents the state-of-the-art on the problem of diagnosis of prion diseases (PD) in humans and animals with a brief description of their etiology and pathogenesis. We pointed out that understanding the nature of the etio logical agent of PD determined their zoonotic potential and led to the development of highly specific immunological diagnostic methods aimed at identifying the infectious isoform of prion protein (PrPd) as the only marker of the disease. In this regard, we briefly summarize the results of studies, including our own, concerning the conversion of normal prion protein molecules (PrPc) to PrPd, the production of monoclonal antibodies and their application as immunodiagnostic reagents for the post-mortem detection of PrPd in various formats of immunoassay. We also emphasize the issues related to the development of methods for ante mortem diagnostics of PD. In this regard, a method for amplifying amino acid sequences using quacking-induced conversion of PrPc to PrPd in real time (RTQuIC) described in details. The results of recent studies on the assessment of the sensitivity, specificity and reproducibility of this method, carried out in various laboratories around the world, are presented. The data obtained indicate that RT-QuIC is currently the most promising laboratory assay for detecting PrPd in biological material at the preclinical stage of the disease. The significant contribution of US scientists to the introduction of this method into clinical practice on the model of diagnosis of chronic wasting disease of wild Cervidae (CWD) is noted. The possible further spread of CWD in the population of moose and deer in the territories bordering with Russia, as well as the established fact of alimentary transmission of CWD to macaques, indicate the threat of the appearance of PD in our country. In conclusion, the importance of developing new hypersensitive and/or selective components of known methods for PrPd identification from the point of view of assessing the risks of creating artificial infectious prion proteins in vivo or in vitro, primarily new pathogenic isoforms (“strains”) and synthetic prions, was outlined.
Full Text
##article.viewOnOriginalSite##About the authors
S. L. Kal’nov
FSBI «National Research Centre of Epidemiology and Microbiology named after honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
Email: kalnov.sergei@mail.ru
ORCID iD: 0000-0002-3130-4790
Ph.D., Senior Scientist
123098, Moscow
Ph.D., Senior Scientist Russian FederationO. A. Verkhovsky
ANO «Diagnostic and Prevention for Human and Animal Diseases Research Institute»
Email: info@dpri.ru
ORCID iD: 0000-0003-0784-9341
Ph.D., D.Sci. (Biol.)., Prof., President
Moscow, 123098
Russian FederationV. V. Tsibezov
FSBI «National Research Centre of Epidemiology and Microbiology named after honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
Email: tsibezov@yandex.ru
ORCID iD: 0000-0003-2150-5764
Ph.D., Leading Researcher
123098, Moscow
Russian FederationK. P. Alekseev
FSBI «National Research Centre of Epidemiology and Microbiology named after honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
Email: kalekseev@hotmail.com
ORCID iD: 0000-0001-9536-3127
PhD, Senior Scientist
123098, Moscow
Russian FederationD. A. Chudakova
School of Biological sciences, University of Auckland
Email: kitsyne1@yandex.ru
ORCID iD: 0000-0002-9354-6824
Research fellow
Auckland 1010
New ZealandI. E. Filatov
FSBI «National Research Centre of Epidemiology and Microbiology named after honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
Email: filat69rus@yandex.ru
ORCID iD: 0000-0001-5274-224X
graduate student, Laboratory of Molecular Diagnostics
123098, Moscow
Russian FederationT. V. Grebennikova
FSBI «National Research Centre of Epidemiology and Microbiology named after honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
Author for correspondence.
Email: t_grebennikova@mail.ru
ORCID iD: 0000-0002-6141-9361
Ph.D., D.Sci. (Biol.). Prof., Corresponding Member of RAS, Head of Laboratory
123098, Moscow
Russian FederationReferences
- Gambetti P., Russo C. Human brain amyloidosis. Nephrol. Dial. Transplant. 1998; 13(Suppl. 7): 33–40. https://doi.org/10.1093/ndt/13.suppl_7.33.
- Lachmann H.J., Hawkins P.N. Systemic amyloidosis. Curr. Opin. Pharm. 2006; 6(2): 214–20. https://doi.org/10.1016/j.coph.2005.10.005.
- McKinley M.P., Prusiner S.B. Ultrastructural Studies of Prions. In: Chesebro B.W., ed. Transmissible Spongiform Encephalopathies: Current Topics in Microbiology and Immunology. Berlin, Heidelberg: Springer; 1991. https://doi.org/10.1007/978-3-642-76540-7_5.
- Prusiner S.B. Novel proteinaceous infection particles cause scrapie. Science. 1982; 216(4542): 136–44. https://doi.org/10.1126/science.6801762.
- Laurent M. Autocatalytic processes in cooperative mechanisms of prion diseases. FEBS Lett. 1997; 407(1): 1–6. https://doi.org/10.1016/s0014-5793(97)00310-4.
- Bieschke J., Weber P., Sarafoff N., Beekes M., Giese A., Kretzschmar H. Autocatalytic self-propagation of misfolded prion protein. Proc. Natl. Acad. Sci. USA. 2004; 101(33): 12207–11. https://doi.org/10.1073/pnas.0404650101.
- Harris D.A. Cellular biology of prion diseases. Clin. Microbiol. Rev. 1999; 12(3): 429–44.
- Hegde R.S., Mastrianni J.A., Scott M.R., DeFea K.A., Tremblay P., Torchia M., et al. A transmembrane form of the prion protein in neurodegenerative disease. Science. 1998; 279(5352): 827–34. https://doi.org/10.1126/science.279.5352.827.
- Mead S. Prion disease genetics. Eur. J. Hum. Genet. 2006; 14(3): 273–81. https://doi.org/10.1038/sj.ejhg.5201544.
- Bessen R.A., Kocisko D.A., Raymond G.J., Nandan S., Lansbury P.T., Caughey B. Non-genetic propagation of strain-specific properties of scrapie prion protein. Nature. 1995; 375(6533): 698–700. https://doi.org/10.1038/375698a0.
- Collinge J., Clarke A.R. A general model of prion strains and their pathogenicity. Science. 2007; 318(5852): 930–6. https://doi.org/10.1126/science.1138718.
- Prusiner S.B. Prions. Proc. Natl. Acad. Sci. USA. 1998; 95(23): 13363–83. https://doi.org/10.1073/pnas.95.23.13363.
- Baskakov I.V., Breydo L. Converting the prion protein: what makes the protein infectious. Biochim. Biophys. Acta. 2007; 1772(6): 692–703. https://doi.org/10.1016/j.bbadis.2006.07.007.
- Benestad S.L., Telling G.C. Chronic wasting disease: an evolving prion disease of cervids. Handb. Clin. Neurol. 2018; 153: 135–51. https://doi.org/10.1016/B978-0-444-63945-5.00008-8.
- Sakudo A. Chronic wasting disease: current assessment of transmissibility. Curr. Issues Mol. Biol. 2020; 36: 13–22. https://doi.org/10.21775/cimb.036.013.
- Зуев В.А., Завалишин И.А., Ройхель В.М. Прионные болезни человека и животных. Руководство для врачей. М.: Медицина; 1999.
- Зуев В.А. Медленные инфекции человека и животных. Вопросы вирусологии. 2014; 59(5): 5–12.
- Надточей Г.А., Шубин В.А., Юров К.П., Коромыслов Г.Ф. Экспериментальные прионные инфекции у животных. Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 1999; 72: 299–305.
- Рыбаков С.С. Скрепи и другие прионные болезни животных и человека. Владимир: Фолиант; 2003.
- Рыбаков С.С. Губкообразная энцефалопатия крупного рогато- го скота. Владимир: Фолиант; 2007.
- Надточей Г.А. Прионные инфекции: диагностика, профилактика и меры борьбы. Бюллетень Всесоюзного ордена Ленина научно-исследовательского института экспериментальной ветеринарии им. Я.Р. Коваленко. 1996; 77: 5–10.
- Суворов В.С., Шубин В.А., Надточей Г.А., Юров К.П., Санджаев Д.Д. Патоморфологическая дифференциация прионных инфекций: скрепи овец и губкообразная энцефалопатия крупного рогатого скота. Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 2003; 73: 60–3.
- Кальнов С.Л., Григорьев В.Б., Алексеев К.П., Власова А.Н., Гибадулин Р.А., Покидышев А.Н. и др. Получение и характеристика полноразмерного рекомбинантного PrPc белка крупного рогатого скота. Бюллетень экспериментальной биологии и медицины. 2006; 141(1): 68–71.
- Grigorjev V.B., Kal’nov S.L., Pokidyshev A.N., Tsibezov V.V., Balandina M.V., Gibadulin R.A., et al. Fibrillization of recombinant bovine prion protein (rec-PrP) in vitro. Dokl. Biochem. Biophys. 2008; 420: 112–4. https://doi.org/10.1134/S1607672908030046.
- Кальнов С.Л., Верховский О.А., Алипер Т.И. Прионные болезни животных. В кн.: Львов Д.К., ред. Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. М.: МИА; 2013: 910–21.
- Покидышев А.Н. Характеристика рекомбинантного прионного белка крупного рогатого скота (Bos taurus) и разработка методов выявления патологической изоформы прионов: Дис. … канд. биол. наук. М.; 2009.
- Григорьев В.Б., Покидышев А.Н., Кальнов С.Л., Клименко С.М. Методы диагностики прионных заболеваний. Вопросы вирусологии. 2009; 54(5): 4–9.
- O’Rourke K.I., Baszler T.V., Parish S.M., Knowles D.P. Preclinical detection of PrPSc in nictitating membrane lymphoid tissue of sheep. Vet. Rec. 1998; 142(18): 489–91. https://doi.org/10.1136/vr.142.18.489.
- O’Rourke K.I., Baszler T.V., Besser T.E., Miller J.M., Cutlip R.C., Wells G.A., et al. Preclinical diagnosis of scrapie by immunohistochemistry of third eyelid lymphoid tissue. J. Clin. Microbiol. 2000; 38(9): 3254–9. https://doi.org/10.1128/JCM.38.9.3254-3259.2000.
- Spraker T.R., VerCauteren K.C., Gidlewski T., Schneider D.A., Munger R., Balachandran A., et al. Antemortem detection of PrPCWD in pre-clinical, ranch-raised Rocky Mountain Elk (Cervus elaphus nelsoni) by biopsy of the rectal mucosa. J. Vet. Diagn. Invest. 2009; 21(1): 15–24. https://doi.org/10.1177/104063870902100103.
- Andréoletti O., Berthon P., Marc D., Sarradin P., Grosclaude J., van Keulen L., et al. Early accumulation of PrPsc in gut-associated lymphoid and nervous tissues of susceptible sheep from a Romanov flock with natural scrapie. J. Gen. Virol. 2000; 81(12): 3115–26. https://doi.org/10.1099/0022-1317-81-12-3115.
- Hilton D.A., Ghani A.C., Conyers L., Edwards P., McCardle L., Ritchie D., et al. Accumulation of prion protein in tonsil and appendix: review of tissue samples. Brit. Med. J. 2002; 325(7365): 633–4. https://doi.org/10.1136/bmj.325.7365.633.
- Saborio G.P., Permanne B., Soto C. Sensitive detection of pathological prion protein by cyclic amplification of protein misfolding. Nature. 2001; 411(6839): 810–3. https://doi.org/10.1038/35081095.
- Saa P., Castilla J., Soto C. Presymptomatic detection of prions in blood. Science. 2006; 313(5783): 92–4. https://doi.org/10.1126/science.1129051.
- Atarashi R., Wilham J.M., Christensen L., Hughson A.G., Moore R.A., Johnson L.M., et al. Simplified ultrasensitive prion detection by recombinant PrP conversion with shaking. Nat. Methods. 2008; 5(3):211–2. https://doi.org/10.1038/nmeth0308-211.
- Atarashi R., Sano K., Satoh K., Nishida N. Real-time quaking-induced conversion: a highly sensitive assay for prion detection. Prion. 2011; 5(3): 150–3. https://doi.org/10.4161/pri.5.3.16893.
- Henderson D.M., Davenport K.A., Haley N.J., Denkers N.D., Mathiason C.K., Hoover E.A. Quantitative assessment of prion infectivity in tissues and body fluids by real-time quaking-induced conversion. J. Gen. Virol. 2015; 96(Pt. 1): 210–9. https://doi.org/10.1099/vir.0.069906-0.
- Dassanayake R.P., Orrú C.D., Hughson A.G., Caughey B., Graça T., Zhuang D., et al. Sensitive and specific detection of classical scrapie prions in the brains of goats by real-time quaking-induced conversion. J. Gen. Virol. 2016; 97(3): 803–12. https://doi.org/10.1099/jgv.0.000367.
- Orrú C.D., Groveman B.R., Raymond L.D., Hughson A.G., Nonno R., Zou W., et al. Bank vole prion protein as an apparently universal substrate for RT-QuIC-based detection and discrimination of prion strains. PLoS Pathog. 2015; 11(6): e1004983. https://doi.org/10.1371/journal.ppat.1004983.
- Favole A., Mazza M., Vallino Costassa E., D’Angelo A., Lombardi G., Marconi P., et al. Early and pre-clinical detection of prion seeding activity in cerebrospinal fluid of goats using real-time quaking- induced conversion assay. Sci. Rep. 2019; 9(1): 6173. https://doi.org/10.1038/s41598-019-42449-7.
- Davenport K.A., Hoover C.E., Denkers N.D., Mathiason C.K., Hoover E.A. Modified protein misfolding cyclic amplification overcomes real-time quaking-induced conversion assay inhibitors in deer saliva to detect Chronic Wasting Disease prions. J. Clin. Microbiol. 2018; 56(9): e00947-18. https://doi.org/10.1128/JCM.00947-18.
- Mammana A., Baiardi S., Rossi M., Franceschini A., Donadio V., Capellari S., et al. Detection of prions in skin punch biopsies of Creutzfeldt-Jakob disease patients. Ann. Clin. Translat. Neurol. 2020; 7(4): 559–64. https://doi.org/10.1002/acn3.51000.
- Bongianni M., Orrú C.D., Groveman B.R., Sacchetto L., Fiorini M., Tonoli G., et al. Diagnosis of human prion disease using real-time quaking-induced conversion testing of olfactory mucosa and cerebrospinal fluid samples. JAMA Neurol. 2017; 74(2): 155–62. https://doi.org/10.1001/jamaneurol.2016.4614.
- McGuire L.I., Poleggi A., Poggiolini I., Suardi S., Grznarova K., Shi S., et al. Cerebrospinal fluid real-time quaking-induced conversion is a robust and reliable test for sporadic Creutzfeldt-Jakob disease: An international study. Ann. Neurol. 2016; 80(1): 160–5. https://doi.org/10.1002/ana.24679.
- Cramm M., Schmitz M., Karch A., Mitrova E., Kuhn F., Schroeder B., et al. Stability and reproducibility underscore utility of RT-QuIC for diagnosis of Creutzfeldt-Jakob disease. Mol. Neurobiol. 2016; 53(3): 1896–904. https://doi.org/10.1007/s12035-015-9133-2.
- Haley N.J., Donner R., Henderson D.M., Tennant J., Hoover E.A., Manca M., et al. Cross-validation of the RT-QuIC assay for the antemortem detection of chronic wasting disease in elk. Prion. 2020; 14(1): 47–55. https://doi.org/10.1080/19336896.2020.1716657.
- Hwang S., Tatum T., Lebepe-Mazur S., Nicholson E.M. Preparation of lyophilized recombinant prion protein for TSE diagnosis by RTQuIC. BMC Res. Notes. 2018; 11(1): 895. https://doi.org/10.1186/s13104-018-3982-5.
- Koutsoumanis K., Allende A., Alvarez-Ordoñez A., Bolton D., Bover-Cid S., Chemaly M., et al. Update on chronic wasting disease (CWD). EFSA J. 2019; 17(11): e05863. https://doi.org/10.2903/j.efsa.2019.5863.
- Schaetzl H. One Health Workshop Series 2020: Chronic Wasting Disease. Zoonotic potential of CWD. Available at: https://ucalgary.zoom.us/rec/play/hja-r64RAavwd07Wv9-D4QAly-36SAILGC_QNqu6j2f6c2F4WhsgM-opx5x56pIDu41zgUwR4moiOAkPf.9-DQ27JE9yCVhyA-?startTime=1602079098000.
- Orrú C.D., Wilham J.M., Raymond L.D., Kuhn F., Schroeder B., Raeber A.J., et al. Prion disease blood test using immunoprecipitation and improved quaking-induced conversion. mBio. 2011; 2(3):e00078-11. https://doi.org/10.1128/mBio.00078-11.
- Denkers N.D., Henderson D.M., Mathiason C.K., Hoover E.A. Enhanced prion detection in biological samples by magnetic particle extraction and real-time quaking-induced conversion. J. Gen. Virol. 2016; 97(8): 2023–9. https://doi.org/10.1099/jgv.0.000515.
- Haley N.J., Richt J.A., Davenport K.A., Henderson D.M., Hoover E.A., Manca M., et al. Design, implementation, and interpretation of amplification studies for prion detection. Prion. 2018; 12(2): 73–82. https://doi.org/10.1080/19336896.2018.1443000.
- Metrick M.A., do Carmo Ferreira N., Saijo E., Hughson A.G., Kraus A., Orrú C.D., et al. Million-fold sensitivity enhancement in proteopathic seed amplification assays for biospecimens by Hofmeister ion comparisons. Proc. Natl. Acad. Sci. USA. 2019; 116(46): 23029–39. https://doi.org/10.1073/pnas.1909322116.
- Saa P., Cervenakova L. Protein misfolding cyclic amplification (PMCA): Current status and future directions. Virus Res. 2015; 207:47–61. https://doi.org/10.1016/j.virusres.2014.11.007.
- Seed C.R., Hewitt P.E., Dodd R.Y., Houston F., Cervenakova L. Creutzfeldt-Jakob disease and blood transfusion safety. Vox Sang. 2018; 113(3): 220–31. https://doi.org/10.1111/vox.12631.
- Kim C., Xiao X., Chen S., Haldiman T., Smirnovas V., Kofskey D., et al. Artificial strain of human prions created in vitro. Nat. Commun. 2018; 9(1): 2166. https://doi.org/10.1038/s41467-018-04584-z.
- Barria M.A., Libori A., Mitchell G., Head M.W. Susceptibility of human prion protein to conversion by Chronic Wasting Disease prions. Emerg. Infect. Dis. 2018; 24(8): 1482–9. https://doi.org/10.3201/eid2408.161888.
- Зуев В.А., Кальнов С.Л., Куликова Н.Ю., Гребенникова Т.В. Современное состояние проблемы прионных болезней и причины их опасности для человека и животных. Вопросы вирусологии. 2020; 65(2): 71–6. https://doi.org/10.36233/0507-4088-2020-65-2-71-76.
- Saijo E., Groveman B.R., Kraus A., Metrick M., Orrú C.D., Hughson A.G., et al. Ultrasensitive RT-QuIC seed amplification assays for disease-associated Tau, α‑synuclein, and prion aggregates. Methods Mol. Biol. 2019; 1873: 19–37. https://doi.org/10.1007/978-1-4939-8820-4_2.
Supplementary files