Antiviral activity of the organic germanium complex with aciclovir against herpes simplex virus (Herpesviridae: Alphaherpesvirinae: Simplexvirus: Human alphaherpesvirus 1/2) in the in vitro and in vivo systems
- Authors: Alimbarova L.M.1, Ambrosov I.V.2, Matelo S.K.2, Barinsky I.F.1
-
Affiliations:
- FSBI «National Research Centre for Epidemiology and Microbiology named after the honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
- «VDS Pharma» LLC
- Issue: Vol 66, No 5 (2021)
- Pages: 368-382
- Section: ORIGINAL RESEARCHES
- URL: https://journal-vniispk.ru/0507-4088/article/view/118181
- DOI: https://doi.org/10.36233/0507-4088-76
- ID: 118181
Cite item
Full Text
Abstract
Introduction. A significant increase in the incidence of various forms of herpesvirus infection (HVI) determines the need to search for new approaches to the modification of one of the basic antiviral drugs aciclovir (ACV) and its dosage forms to improve their biopharmaceutical characteristics and increase the effectiveness of therapy. In this aspect, an innovative organic germanium complex with aciclovir (OGCA) is promising.
The aim of the study was to assess the antiviral activity of OGCA against the herpes simplex virus (HSV) (human herpes virus, HHV) on the HVI models both in vitro and in vivo.
Material and methods. We studied the activity of OGCA in a therapeutic regimen against HSV-1 (HHV-1) (Kl strain), HSV-2 (HHV-2) (VN strain) using virological and statistical research methods in the in vitro model of HVI on Vero cell culture and the model of genital herpes (GH) caused by HHV-2 (VN strain) in male guinea pigs (Canis porcellus).
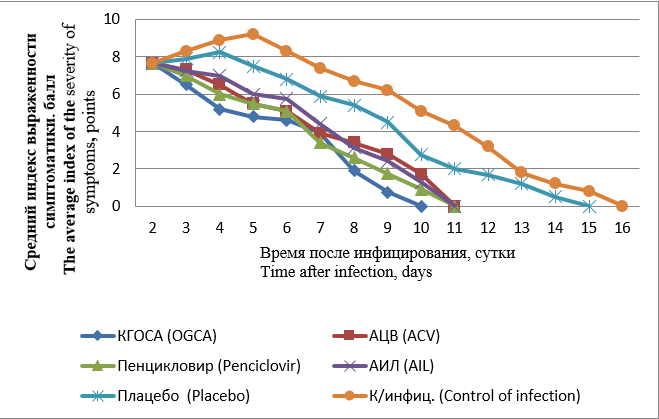
Results and discussion. It was found OGCA inhibits the replication of HHV-1 and HHV-2 in Vero cells, and has anti-HHV activity in the GH model in male guinea pigs, leading to a decrease in the severity and duration of the disease, the intensity and duration of viral shedding. The most pronounced activity was detected when preparation was applied topically 5 times a day for 5 days at the early stages of infection (3% gel). The delayed use of OGCA (48 hours after infection) also had statistically significant efficacy compared to commercial reference drugs containing aciclovir or its pro-drugs: aciclovir (5% cream), AIL (acyclovir+interferon alfa-2b+lidocaine, 3% ointment), penciclovir (1% cream). OGCA significantly reduced the number of days of the pathogen shedding, as well as its infectivity, compared to animals in the control group and ones receiving placebo. The activity of OGCA, apparently, is due to its improved biopharmaceutical characteristics compared to aciclovir, as well as the presence of a number of biological activities of its constituent components.
Conclusion. The results of the study allow us to consider OGCA as the basis for the development of antiviral agents for the treatment of HVI.
Full Text
##article.viewOnOriginalSite##About the authors
L. M. Alimbarova
FSBI «National Research Centre for Epidemiology and Microbiology named after the honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
Author for correspondence.
Email: virology@mail.ru
ORCID iD: 0000-0002-8972-3111
Ludmila M. Alimbarova, Ph.D. (Med.), Associate Professor, Lead Researcher of the Comparative Virology Laboratory with the Russian Centre for Herpes
123098, Moscow, Russia
Russian FederationI. V. Ambrosov
«VDS Pharma» LLC
ORCID iD: 0000-0001-7418-8171
123592, Moscow, Russia
Russian FederationS. K. Matelo
«VDS Pharma» LLC
ORCID iD: 0000-0002-1752-042X
123592, Moscow, Russia
Russian FederationI. F. Barinsky
FSBI «National Research Centre for Epidemiology and Microbiology named after the honorary academician N.F. Gamaleya» of the Ministry of Health of Russia
ORCID iD: 0000-0001-6959-9988
123098, Moscow, Russia
Russian FederationReferences
- Roizman B., Knipe D.M., Whitley R.J. Herpes Simplex Viruses. In: Knipe D.M., Howley P.M., Cohen J.I., Griffin D.E., Lamb R.A., Martin M.A., еds. Fields Virology. Philadelphia, PA: Wolters Kluwer/Lippincott Williams & Wilkins; 2013: 1823–97.
- Исаков В.А., ред. Герпесвирусные инфекции человека: руководство для врачей. СПб.: СпецЛит; 2013.
- Looker K.J., Magaret A.S., May M.T., Turner K.M.E., Vickerman P., Gottlieb S.L., et al. Global and regional estimates of prevalent and incident Herpes Simplex Virus type 1 infections in 2012. PLoS One. 2015; 10(10): e0140765. https://doi.org/10.1371/journal.pone.0140765
- James C, Harfouche M., Welton N.J., Turner K.M.E., Abu-Raddad L.J., Gottlieb S.L., et al. Herpes Simplex Virus: global infection prevalence and incidence estimates, 2016. Bull. World Health Organ. 2020; 98(5): 315–29. https://doi.org/10.2471/BLT.19.237149
- Whitley R., Вaines J. Clinical management of herpes simplex virus infections: past, present and future. F1000Res. 2018; 7: 1726. https://doi.org/10.12688/f1000researh.16157.1
- James S.H., Prichard M.N. Current and future therapies for herpes simplex virus infections: mechanism of action and drug resistance. Curr. Opin. Virol. 2014; 8: 54–61. https://doi.org/10.1016/j.coviro.2014.06.003
- Piret J., Boivin G. Antiviral resistance in herpes simplex virus and varicella-zoster virus infections: diagnosis and management. Curr. Opin. Infect. Dis. 2016; 29(6): 654–62. https://doi.org/10.1097/QCO.0000000000000288
- Burrel S., Aime C., Hermet L., Ait-Arkoub Z., Agut H., Boutolleau D. Surveillance of herpes simplex virus resistance to antivirals: a 4-year survey. Antiviral Res. 2013; 100(2): 365–72. https://doi.org/10.1016/j.antiviral.2013.09.012
- Vere Hodge R.A., Field H.J. Antiviral agents for herpes simplex virus. Adv. Pharmacol. 2013; 67: 1–38. https://doi.org/10.1016/B978-0-12-405880-4.00001-9
- Viljoen J.M., Botes D., Steenekamp J.H. Formulation and evaluation of selected transmucosal dosage forms containing a double fixed-dose of acyclovir and ketoconazole. Eur. J. Pharm. Sci. 2018; 111: 503–13. https://doi.org/10.1016/j.ejps.2017.10.033
- Birkmann A., Zimmermann H. HSV antivirals – current and future treatment options. Curr. Opin. Virol. 2016; 18: 9–13. https://doi.org/10.1016/j.coviro.2016.01.013
- Исаев А.Д., Манашеров T.О., Амбросов И.В., Матело С.К. Комплексные соединения германия с производными азотистых оснований пуринового ряда, способы их получения и содержащие их лекарственные средства. Патент РФ RU2487878C1; 2013.
- Комаров Б.А., Зеленков В.Н., Погорельская Л.В., Албулов А.И. Элемент германий и биологическая активность его соединений. В кн.: Нетрадиционные природные ресурсы, инновационные технологии и продукты. М.; 2016: 169–78.
- Sekhon B.S. Metalloid compounds as drugs. Res. Pharm. Sci. 2013; 8(3): 145–58.
- Cho J.M., Chae J., Jeong S.R., Moon M.J., Shin D.Y., Lee J.H. Immune activation of Bio-Germanium in a randomized, doubleblind, placebo-controlled clinical trial with 130 human subjects: Therapeutic opportunities from new insights. PLoS One. 2020; 19; 15(10): e0240358. https://doi.org/10.1371/journal.pone.0240358
- Миронов А.Н., Бунатян Н.Д., Васильев А.Н., Верстакова О.Л., Журавлёва М.В., Лепахин В.К., и др. Руководство по проведению доклинических исследований лекарственных средств. Часть 1. М.: Гриф и К; 2012.
- Reed L., Muench H. A simple method of estimating 50% endpoints. Amer. J. Hygiene. 1938; 27: 493–7.
- Osano E., Kishi J., Takahashi Y. Phagocytosis of titanium particles and necrosis in TNF-alpha-resistant mouse sarcoma L929 cells. Toxicol. In Vitro. 2003; 17(1): 41–7. https://doi.org/10.1016/s0887-2333(02)00127-3
- Алимбарова Л.М., Керимов Т.З., Борзенок С.А. Изучение противовирусной активности жидких сред для хранения роговицы в отношении вируса простого герпеса in vitro. Вопросы вирусологии. 2020; 65(4): 228–36. https://doi.org/10.36233/0507-4088-2020-65-4-228-236
- Юнкеров В.И., Григорьев С.Г. Математико-статистическая обработка данных медицинских исследований. СПб.: ВМедА; 2002.
- Cotarelo M., Catalán P., Sánchez-Carrillo C., Menasalvas A., Cercenado E., Tenorio A., et al. Cytopathic effect inhibition assay for determining the in vitro susceptibility of herpes simplex virus to antiviral agents. J. Antimicrob. Chemother. 1999; 44(5): 705–8. http://doi.org/10.1093/jac/44.5.705
- Kruppenbacher J.P., Klass R., Eggers H.J. A rapid and reliable assay for testing acyclovir sensitivity of clinical herpes simplex virus isolates independent of virus dose and reading time. Antiviral Res. 1994; 23(1): 11–22. https://doi.org/10.1016/0166-3542(94)90029-9
- Novoselova E.A., Alimbarova L.M., Monakhova N.S., Lepioshkin A.Yu., Ekins S., Makarov V.A. In vivo activity of pyrimidine-dispirotripiperazinium in in the male guinea pig model of genital herpes. J. Virol. Antivir. Res. 2020; 9(1). https://doi.org/10.37532/jva.2020.9(1).193
- Пшеничников В.А., Семёнов Б.Ф., Зезеров Е.Г. Стандартизация методов вирусологических исследований. М.: Медицина; 1974.
- Kern E.R., Richards J.T., Overall J.C., Glasgow L.A. Acyclovir treatment of experimental genital herpes simplex virus infections. I. Topical therapy of type 2 and type 1 infections of mice. Antiviral Res. 1983; 3(4): 253–67. https://doi.org/10.1016/0166-3542(83)90004-9.
- Kern E.R., Palmer J., Szczech G., Painter G., Hostetler K.Y. Efficacy of topical acyclovir monophosphate, acyclovir, or penciclovir in orofacial HSV-1 infections of mice and genital HSV-2 infections of guinea pigs. Nucleosides Nucleotides Nucleic Acids. 2000; 19(1-2): 501–13. https://doi.org/10.1080/15257770008033024
- Андронова В.Л., Ясько В.М., Куханова М.К., Галегов Г.А., Скоблов Ю.С., Кочетков С.Н. Антигерпесвирусная эффективность фосфита ациклогуанозина, преодолевающего барьер резистентности к ацикловиру. Acta Naturae. 2016; 8(1): 81–8.
- Rajpoot K. Acyclovir-loaded sorbitan esters-based organogel: development and rheological characterization. Artif. Cells Nanomed. Biotechnol. 2017; 45(3): 551–9. https://doi.org/10.3109/21691401.2016.1161639
- Rodrigues L.N.C., Zanluchi J.M., Grebogi I.H. Percutaneous absorption enhancers: Mechanisms and potential. Braz. Arch. Biol. Technol. 2007; 50(6): 949–61. https://doi.org/10.1590/S1516-89132007000700006
Supplementary files