In situ gels as a modern method of intranasal vaccine delivery
- Authors: Bakhrushina E.O.1, Mikhel J.B.1, Kondratieva V.M.2, Demina N.B.1, Grebennikova T.V.2
-
Affiliations:
- I.M. Sechenov First Moscow State Medical University of the Ministry of Health of Russia
- National Research Center of Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of Russia
- Issue: Vol 67, No 5 (2022)
- Pages: 395-402
- Section: REVIEWS
- URL: https://journal-vniispk.ru/0507-4088/article/view/118234
- DOI: https://doi.org/10.36233/0507-4088-139
- ID: 118234
Cite item
Abstract
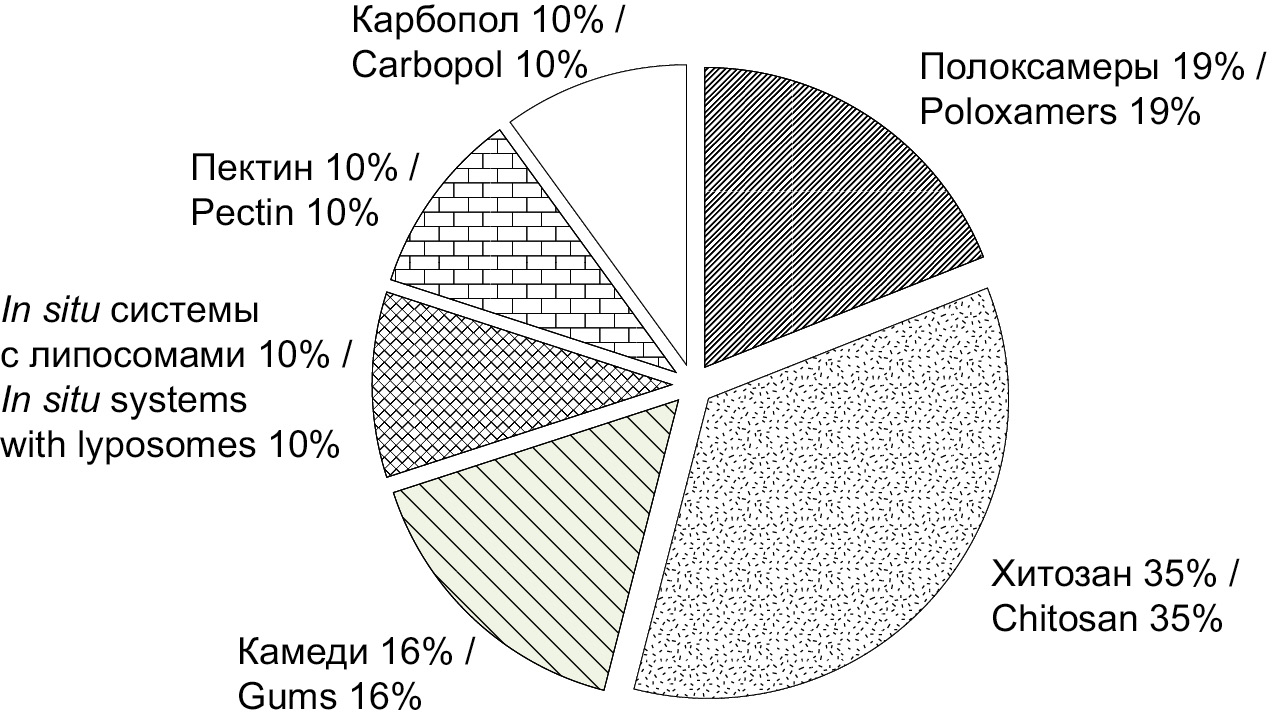
The continuous emergence of new pathogens and the evolution of microbial drug resistance make it absolutely necessary to develop innovative, effective vaccination strategies. Use of nasal vaccination can increase convenience, safety, cause both local and systemic immune reactions. Intranasal administration nevertheless has a number of shortcomings that can be overcome by using the latest achievements of pharmaceutical science. One of the aspects of such solution may be the use of systems for the production of intranasal vaccines in situ – polymer compositions that provide a directed sol-gel transition controlled by the physiological conditions of the nasal cavity. At the same time, the gelation of the administered dose in contact with the nasal mucosa involves prolonged exposure of the drug at the injection site, greater mucoadhesion, counteraction to mucociliary clearance, modified and more complete release. A number of both foreign and domestic manufacturers produces polymers such as chitosan, gums, polyoxyethylene and polyoxypropylene block copolymers (poloxamers, proxanols), carbomers. For effective pharmaceutical development of new intranasal IBD delivery systems corresponding to the QbD concept, not only the knowledge of the range of excipients is necessary, but also simple, accessible, and reproducible methods for determining indicators that define the critical parameters of such delivery systems. In accordance with the conducted scientific search, the main indicators of standardization of in situ intranasal systems were identified: temperature and time of gel formation, gel strength, rheological characteristics, mucoadhesion, release, nasal mucociliary clearance time.
Full Text
##article.viewOnOriginalSite##About the authors
Elena O. Bakhrushina
I.M. Sechenov First Moscow State Medical University of the Ministry of Health of Russia
Author for correspondence.
Email: bakhrushina_e_o@staff.sechenov.ru
ORCID iD: 0000-0001-8695-0346
PhD, Associate Professor, Associate Professor of the department of Pharmaceutical Technologies
Russian Federation, 119048, MoscowJoseph B. Mikhel
I.M. Sechenov First Moscow State Medical University of the Ministry of Health of Russia
Email: mikheliosif@gmail.com
ORCID iD: 0000-0002-2866-0049
Student of the 5th year of the OD of the Institute of Pharmacy. A.P. Nelyubina
Russian Federation, 119048, MoscowValeria M. Kondratieva
National Research Center of Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of Russia
Email: 1999valeriak@mail.ru
ORCID iD: 0000-0001-9163-4516
Graduate student
Russian Federation, 123098, MoscowNatalia B. Demina
I.M. Sechenov First Moscow State Medical University of the Ministry of Health of Russia
Email: demina_n_b@staff.sechenov.ru
ORCID iD: 0000-0003-4307-8791
Doctor of Pharmaceutical Sciences, Professor, Professor at the department of Pharmaceutical and Biomedical Technology
Russian Federation, 119048, MoscowTatyana V. Grebennikova
National Research Center of Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of Russia
Email: t_grebennikova@mail.ru
ORCID iD: 0000-0002-6141-9361
Doctor of Biological Sciences, Professor, Corresponding Member RAS, Head Laboratory of Molecular Diagnostics, Head of department of Molecular Vaccinology and Immunodiagnostics
Russian Federation, 123098, MoscowReferences
- Xu H., Cai L., Hufnagel S., Cui Z. Intranasal vaccine: Factors to consider in research and development. Int. J. Pharm. 2021; 609: 121180. https://doi.org/10.1016/j.ijpharm.2021.121180
- Ivanov B.A. Russian literature on microbiology, immunology, infectious diseases and epidemiology published during the final months of 1954 and during the first quarter of 1955. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 1955; 32(12): 97–105. (in Russian)
- Rozenberg Kh.M. Experimental studies on intranasal BCG vaccination. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 1954; 31(7): 75–81. (in Russian)
- Porfir’eva N.N., Semina I.I., Mustafin R.I., Khutoryanskiy V.V. Intranasal administration as a route to deliver drugs to the brain (review). Razrabotka i registratsiya lekarstvennykh sredstv. 2021; 10(4): 117–27. https://doi.org/10.33380/2305-2066-2021-10-4-117-127
- Kunel’skaya N.L., Artem’eva-Karelova A.V. The main components of nasal secretions: mucoactive drugs. Lechebnoe delo. 2013; (3): 5–7. (in Russian)
- Bakhrushina E.O., Demina N.B., Shumkova M.M., Rodyuk P.S., Shulikina D.S., Krasnyuk I.I. In situ intranasal delivery systems: application prospects and main pharmaceutical aspects of development (review). Razrabotka i registratsiya lekarstvennykh sredstv. 2021; 10(4): 54–63. https://doi.org/10.33380/2305-2066-2021-10-4-54-63 (in Russian)
- Ivanushko L.A., Solov’eva T.F., Zaporozhets T.S., Somova L.M., Gorbach V.I. Antibacterial and antitoxic properties of chitosan and its derivatives. Tikhookeanskiy meditsinskiy zhurnal. 2009; (3): 82–5. (in Russian)
- Kempe S., Mäder K. In situ forming implants – an attractive formulation principle for parenteral depot formulations. J. Control. Release. 2012; 161(2): 668–79. https://doi.org/10.1016/j.jconrel.2012.04.016
- Vigani B., Rossi S., Sandri G., Bonferoni M.C., Caramella C.M., Ferrari F. Recent advances in the development of in situ gelling drug delivery systems for non-parenteral administration routes. Pharmaceutics. 2020; 12(9): 859. https://doi.org/10.3390/pharmaceutics12090859
- Bedford J.G., Caminschi I., Wakim L.M. Intranasal delivery of a chitosan-hydrogel vaccine generates nasal tissue resident memory CD8+ t cells that are protective against influenza virus infection. Vaccines (Basel). 2020; 8(4): 572. https://doi.org/10.3390/vaccines8040572
- Ozbılgın N.D., Saka O.M., Bozkır A. Preparation and in vitro/in vivo evaluation of mucosal adjuvant in situ forming gels with diphtheria toxoid. Drug Deliv. 2014; 21(2): 140–7. https://doi.org/10.3109/10717544.2013.834754
- Zhao K., Shi X., Zhao Y., Wei H., Sun Q., Huang T., et al. Preparation and immunological effectiveness of a swine influenza DNA vaccine encapsulated in chitosan nanoparticles. Vaccine. 2011; 29(47): 8549–56. https://doi.org/10.1016/j.vaccine.2011.09.029
- Majcher M.J., Babar A., Lofts A., Leung A., Li X., Abu-Hijleh F., et al. In situ-gelling starch nanoparticle (SNP)/O-carboxymethyl chitosan (CMCh) nanoparticle network hydrogels for the intranasal delivery of an antipsychotic peptide. J. Control. Release. 2021; 330: 738–52. https://doi.org/10.1016/j.jconrel.2020.12.050
- Agrawal A.K., Gupta P.N., Khanna A., Sharma R.K., Chandrawanshi H.K., Gupta N., et al. Development and characterization of in situ gel system for nasal insulin delivery. Pharmazie. 2010; 65(3): 188–93.
- Luppi B., Bigucci F., Mercolini L., Musenga A., Sorrenti M., Catenacci L., et al. Novel mucoadhesive nasal inserts based on chitosan/hyaluronate polyelectrolyte complexes for peptide and protein delivery. J. Pharm. Pharmacol. 2009; 61(2): 151–7. https://doi.org/10.1211/jpp/61.02.0003
- Wang Q., Wong C.H., Chan H.Y.E., Lee W.Y., Zuo Z. Statistical Design of Experiment (DoE) based development and optimization of DB213 in situ thermosensitive gel for intranasal delivery. Int. J. Pharm. 2018; 539(1-2): 50–7. https://doi.org/10.1016/j.ijpharm.2018.01.032
- Ahmad N., Ahmad R., Ahmad F.J., Ahmad W., Alam M.A., Amir M., et al. Poloxamer-chitosan-based Naringenin nanoformulation used in brain targeting for the treatment of cerebral ischemia. Saudi J. Biol. Sci. 2020; 27(1): 500–17. https://doi.org/10.1016/j.sjbs.2019.11.008
- Díaz A.G., Quinteros D.A., Gutiérrez S.E., Rivero M.A., Palma S.D., Allemandi D.A., et al. Immune response induced by conjunctival immunization with polymeric antigen BLSOmp31 using a thermoresponsive and mucoadhesive in situ gel as vaccine delivery system for prevention of ovine brucellosis. Vet. Immunol. Immunopathol. 2016; 178: 50–6. https://doi.org/10.1016/j.vetimm.2016.07.004
- Zadeh S.N., Rajabnezhad S., Zandkarimi M., Dahmardeh S., Mir L., Darbandi M.A., et al. Mucoadhesive microspheres of chitosan and polyvinyl alcohol as a carrier for intranasal delivery of insulin: in vitro and in vivo studies. MOJ Bioequiv. Availab. 2017; 3(2): 00030.
- Krauland A.H., Guggi D., Bernkop-Schnürch A. Thiolated chitosan microparticles: a vehicle for nasal peptide drug delivery. Int. J. Pharm. 2006; 307(2): 270–7. https://doi.org/10.1016/j.ijpharm.2005.10.016
- Das S.S., Kar S., Singh S.K., Hussain A., Verma P.R.P., Beg S. Chapter 13: Carboxymethyl chitosan in advanced drug-delivery applications. In: Hasnain M.S., Beg S., Nayak A.K., eds. Chitosan in Drug Delivery. Academic Press; 2022: 323–60. https://doi.org/10.1016/B978-0-12-819336-5.00006-6
- Park J.S., Oh Y.K., Yoon H., Kim J.M., Kim C.K. In situ gelling and mucoadhesive polymer vehicles for controlled intranasal delivery of plasmid DNA. J. Biomed. Mater. Res. 2002; 59(1): 144–51. https://doi.org/10.1002/jbm.1227
- Mura P., Mennini N., Nativi C., Richichi B. In situ mucoadhesive-thermosensitive liposomal gel as a novel vehicle for nasal extended delivery of opiorphin. Eur. J. Pharm. Biopharm. 2018; 122: 54–61. https://doi.org/10.1016/j.ejpb.2017.10.008
- Otero-Espinar F.J., Fernández-Ferreiro A., González-Barcia M., Blanco-Méndez J., Luzardo A. Chapter 6: Stimuli sensitive ocular drug delivery systems. In: Grumezescu A.M., ed. Drug Targeting and Stimuli Sensitive Drug Delivery Systems. William Andrew Publishing; 2018: 211–70. https://doi.org/10.1016/B978-0-12-813689-8.00006-9
- Tian J.L., Zhao Y.Z., Jin Z., Lu C.T., Tang Q.Q., Xiang Q., et al. Synthesis and characterization of Poloxamer 188-grafted heparin copolymer. Drug Dev. Ind. Pharm. 2010; 36(7): 832–8. https://doi.org/10.3109/03639040903520983
- Zylke J. Poloxamer 188 for Sickle Cell Disease. JAMA. 2021; 325(15): 1524. https://doi.org/10.1001/jama.2021.3399
- Emanuele M., Balasubramaniam B. Differential effects of commercial-grade and purified poloxamer 188 on renal function. Drugs R.D. 2014; 14(2): 73–83. https://doi.org/10.1007/s40268-014-0041-0
- Li Y., Cui Y., Li L., Lin X., Zhou X., Zhu H., et al. A UHPLC-Q-TOF/MS method for the determination of poloxamer 124 and its application in a tissue distribution study in rats. Anal. Methods. 2021; 13(45): 5516–22. https://doi.org/10.1039/d1ay01373d
- Li Y., Cui Y., Li L., Lin X., Zhou X., Zhu H., et al. Ultra-high-performance liquid chromatography coupled with quadrupole time of flight mass spectrometry method for quantifying polymer poloxamer 124 and its application to pharmacokinetic study. J. Sep. Sci. 2021; 44(20): 3822–9. https://doi.org/10.1002/jssc.202100552
- Bakhrushina E.O., Novozhilova E.V., Kashperko A.S., Sokolova A.V., Demina N.B., Krasnyuk I.I. Biopharmaceutical study of binary poloxamer systems as in situ drug delivery systems poloxamer polycomplexes: The study. Int. J. Appl. Pharm. 2022; 14(3): 162–5. https://doi.org/10.22159/ijap.2022v14i3.43930
- Arshintseva E.V., Pushkin S.Yu. Comparative study of acute toxicity of poloxamers with intravenous administration in outbred rats. Internauka: nauchnyy zhurnal. 2022; 13(236). https://doi.org/10.32743/26870142.2022.13.236.336593 (in Russian)
- Vorob’ev S.I. New approach toward clinical trial design of targeted agents. Rossiyskiy bioterapevticheskiy zhurnal. 2009; 8(3): 3–8. (in Russian)
- Kola M., Puri G.K., Unnisa M.T., Swapna J., Phanivarma K. Formulation, optimization and evaluation of rasagiline mesylate in situ nasal gel. Indo Am. J. Pharm. Res. 2018; 8(09): 1645–54.
- Bertram U., Bernard M.C., Haensler J., Maincent P., Bodmeier R. In situ gelling nasal inserts for influenza vaccine delivery. Drug Dev. Ind. Pharm. 2010; 36(5): 581–93. https://doi.org/10.3109/03639040903382673
- Thakkar J.H., Prajapati S.T. Formulation development and characterization of in-situ gel of Rizatriptan Benzoate for intranasal delivery. J. Drug Deliv. Ther. 2021; 11(1-S): 1–6.
- Bertram U., Bodmeier R. In situ gelling, bioadhesive nasal inserts for extended drug delivery: in vitro characterization of a new nasal dosage form. Eur. J. Pharm. Sci. 2006; 27(1): 62–71. https://doi.org/10.1016/j.ejps.2005.08.005
- Cao S.L., Ren X.W., Zhang Q.Z., Chen E., Xu F., Chen J., et al. In situ gel based on gellan gum as new carrier for nasal administration of mometasone furoate. Int. J. Pharm. 2009; 365(1-2): 109–15. https://doi.org/10.1016/j.ijpharm.2008.08.042
- Demina N.B., Bakhrushina E.O., Bardakov A.I., Krasnyuk I.I. Design of intranasal dosage forms: biopharmaceutical aspects. Farmatsiya. 2019; 68(3): 12–7. (in Russian)
- Maia F.R., Correlo V.M., Oliveira J.M., Reis R.L. Chapter 32: Natural origin materials for bone tissue engineering: properties, processing, and performance. In: Atala A., Lanza R., Mikos A.G., Nerem R., eds. Principles of Regenerative Medicine (Third Edition). Academic Press; 2019: 535–58. https://doi.org/10.1016/B978-0-12-809880-6.00032-1
- Ball J.P., Springer M.J., Ni Y., Finger-Baker I., Martinez J., Hahn J., et al. Intranasal delivery of a bivalent norovirus vaccine formulated in an in situ gelling dry powder. PLoS One. 2017; 12(5): e0177310. https://doi.org/10.1371/journal.pone.0177310
- Velasquez L.S., Shira S., Berta A.N., Kilbourne J., Medi B.M., Tizard I., et al. Intranasal delivery of Norwalk virus-like particles formulated in an in situ gelling, dry powder vaccine. Vaccine. 2011; 29(32): 5221–31. https://doi.org/10.1016/j.vaccine.2011.05.027
- Dukovski B.J., Plantić I., Čunčić I., Krtalić I., Juretić M., Pepić I., et al. Lipid/alginate nanoparticle-loaded in situ gelling system tailored for dexamethasone nasal delivery. Int. J. Pharm. 2017; 533(2): 480–7. https://doi.org/10.1016/j.ijpharm.2017.05.065
- Giri T.K. 5-nanoarchitectured polysaccharide-based drug carrier for ocular therapeutics. In: Holban A.M., Mihai G.A. Nanoarchitectonics for Smart Delivery and Drug Targeting. William Andrew Publishing; 2016: 119–41. https://doi.org/10.1016/B978-0-323-47347-7.00005-7
- Iklasova A.Sh., Sakipova Z.B., Bekbolatova E.N. Pectin: composition, technology of production, application in food and pharmaceutical industry. Vestnik Kazakhskogo natsional’nogo meditsinskogo universiteta. 2018; (3): 243–6. (in Russian)
- Patil P.R., Salve V.K., Thorat R.U., Sadhana S. Formulation and evaluation of ion-sensitive in-situ nasal gel of Zolmitriptan. Int. J. Pharm. Pharm. Sci. 2015; (7): 478–86.
- Gaganjot K., Grewal J., Jyoti K., Jain U.K., Chandra R., Madan J. Chapter 15: Oral controlled and sustained drug delivery systems: Concepts, advances, preclinical, and clinical status. In: Grumezescu A.M., ed. Drug Targeting and Stimuli Sensitive Drug Delivery Systems. William Andrew Publishing; 2018: 567–626. https://doi.org/10.1016/B978-0-12-813689-8.00015-X.
- Tiwari S., Goyal A.K., Mishra N., Vaidya B., Mehta A., Dube D., et al. Liposome in situ gelling system: Novel carrier based vaccine adjuvant for intranasal delivery of recombinant protein vaccine. Procedia Vaccinol. 2009; 1(1): 148–63. https://doi.org/10.1016/j.provac.2009.07.027
- Brkich G.E., Pyatigorskaya N.V., Kargin V.S., Zyryanov O.A. Development of the design of a study to determine the efficiency and safety of innovative drug. Mediko-farmatsevticheskiy zhurnal «Pul’s». 2022; 24(5): 19–23. https://doi.org/10.26787/nydha-2686-6838-2022-24-5-19-23 (in Russian)
- Zyryanov O.A. Development of the composition and technology for obtaining a dosage form based on triazatricyclotetradecane potential modulator of the AMPA receptor: Diss. Moscow; 2021. (in Russian)
- Flórez Borges P., García-Montoya E., Pérez-Lozano P., Jo E., Miñarro M., Manich A., et al. The role of SeDeM for characterizing the active substance and polyvinyilpyrrolidone eliminating metastable forms in an oral lyophilizate-A preformulation study. PLoS One. 2018; 13(4): e0196049. https://doi.org/10.1371/journal.pone.0196049
- Gulenkov A.S., Mizina P.G., Bakhrushina E.O., Bardakov A.I., Nyudochkin A.V. Рharmaceutical-technological study of adsorbed liquid plant extract of antimicrobial activity. Razrabotka i registratsiya lekarstvennykh sredstv. 2022; 11(2): 94–101. https://doi.org/10.33380/2305-2066-2022-11-2-94-101 (in Russian)
- Bakhrushina E.O., Anurova M.N., Aleshkin A.V., Demina N.B., Krasnyuk I.I., Pyatigorskaya N.V., et al. Modern tendencies of the use and development of drugs of bacteriophages. Vestnik Rossiyskoy akademii meditsinskikh nauk. 2021; 76(4): 351–60. https://doi.org/10.15690/vramn1380 (in Russian)
- Gilbert J.C., Richardson J.L., Davies M.C., Palin K.J., Hadgraft J. The effect of solutes and polymers on the gelation properties of pluronic F-127 solutions for controlled drug delivery. J. Control. Release. 1987; 5(2): 113–8. https://doi.org/10.1016/0168-3659(87)90002-2
- Nižić L., Ugrina I., Špoljarić D., Saršon V., Kučuk M.S., Pepić I., et al. Innovative sprayable in situ gelling fluticasone suspension: Development and optimization of nasal deposition. Int. J. Pharm. 2019; 563: 445–56. https://doi.org/10.1016/j.ijpharm.2019.04.015
- Zaki N.M., Awad G.A., Mortada N.D., Elhady S.S.A. Enhanced bioavailability of metoclopramide HCl by intranasal administration of a mucoadhesive in situ gel with 28 modulated rheological and mucociliary transport properties. Eur. J. Pharm. Sci. 2007; 32(4-5): 296–307. https://doi.org/10.1016/j.ejps.2007.08.006