Вирус Эпштейна–Барр (Orthoherpesviridae: Lymphocryptovirus) у этносов России: распространенность типов ВЭБ (ВЭБ-1 и ВЭБ-2), варианты гена LMP1 и злокачественные опухоли
- Авторы: Гурцевич В.Э.1, Лубенская А.К.1, Сенюта Н.Б.1, Смирнова К.В.1,2,3
-
Учреждения:
- НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
- ФГАОУ ВО «Российский университет дружбы народов»
- ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
- Выпуск: Том 69, № 1 (2024)
- Страницы: 56-64
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://journal-vniispk.ru/0507-4088/article/view/254059
- DOI: https://doi.org/10.36233/0507-4088-214
- EDN: https://elibrary.ru/fibzll
- ID: 254059
Цитировать
Аннотация
Введение. Открытие двух типов вируса Эпштейна–Барр (ВЭБ) ‒ ВЭБ-1 и ВЭБ-2 ‒ стимулировало изучение их распространенности в популяциях и связи со злокачественными опухолями.
Цель исследования. Изучить персистенцию ВЭБ-1 и ВЭБ-2 среди этносов России, проанализировать ПЦР-продукты гена LMP1 в изолятах вируса и оценить вклад типов ВЭБ в заболеваемость злокачественными новообразованиями.
Материалы и методы. Изоляты ВЭБ, амплифицированные из смывов ротовой полости представителей республик Адыгея, Калмыкия, Татарстан и Московской области (МО), изучали методом гнездной ПЦР на принадлежность к ВЭБ-1 и ВЭБ-2. Ампликоны LMP1, полученные с помощью ПЦР в реальном времени из ДНК вирусных изолятов, подвергали классификации и секвенированию на автоматическом секвенаторе ДНК ABI PRISM 3100-Avant (США), а результаты секвенирования анализировали с помощью программ Chromas 230 и Vector NT (Invitrogen, США). Достоверность полученных данных оценивали с помощью статистических пакетов Statistica for Windows 10.0.
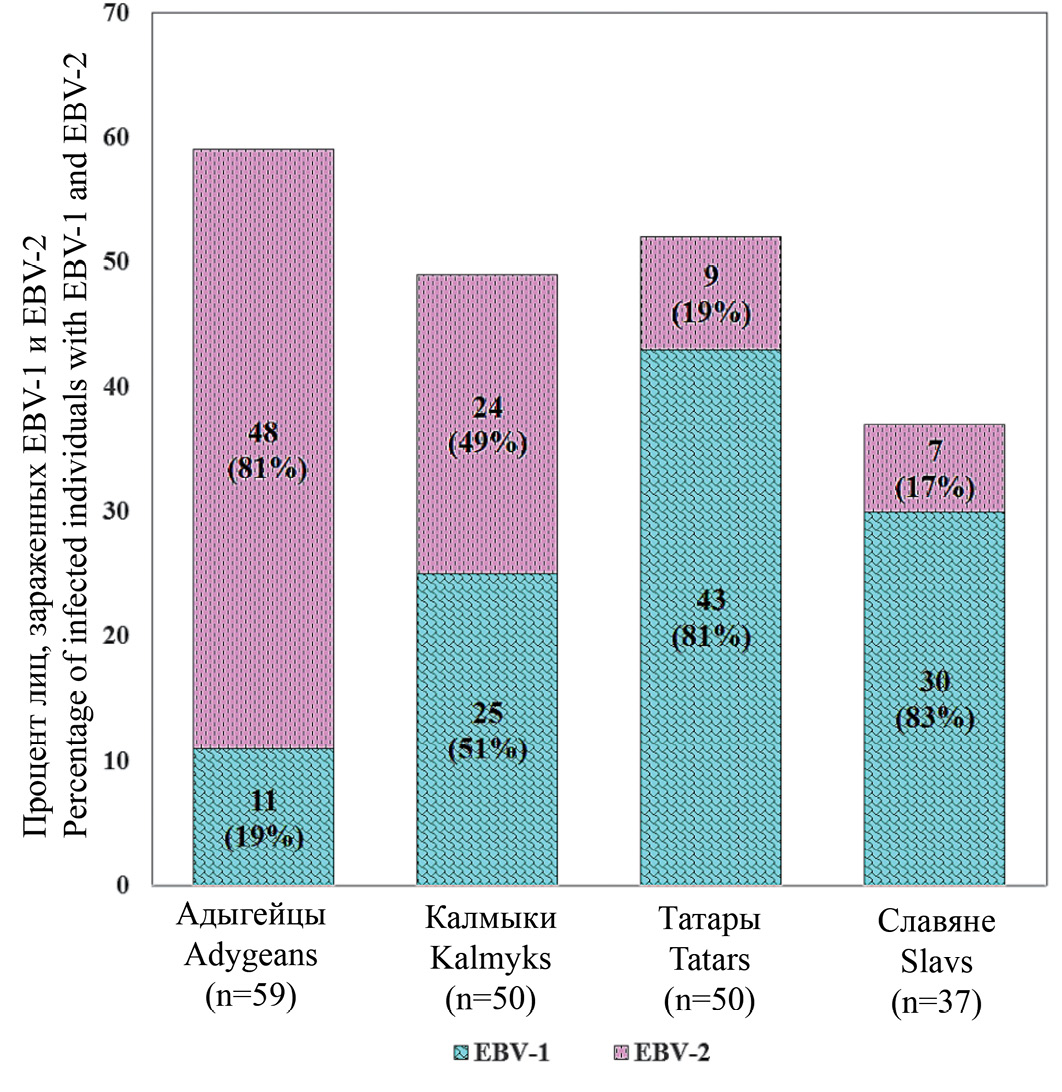
Результаты. Показатели распространенности ВЭБ-1 и ВЭБ-2 у представителей четырех этносов сравнивали с уровнями заболеваемости некоторыми опухолями у населения трех республик и МО. Доминирующая персистенция трансформирующего in vitro ВЭБ-1 у представителей Татарстана и МО коррелировала среди населения этих территорий с высокой заболеваемостью раком желудка и лимфомами. Напротив, преобладающее инфицирование не трансформирующим in vitro ВЭБ-2 представителей Адыгеи и обоими типами вируса примерно у одинакового процента представителей Калмыкии коррелировало с более низкой заболеваемостью вышеуказанными опухолями населения этих республик. Различия между показателями заболеваемости указанными новообразованиями в сравниваемых этнических популяциях были статистически недостоверными (р > 0,05). Обнаруженные варианты LMP1 не отражали ни уровень персистенции типов ВЭБ, ни частоту возникновения опухолей.
Заключение. Инфицированность этносов ВЭБ-1 и ВЭБ-2 может существенно различаться под влиянием разных факторов. Преобладание в популяции трансформирующего in vitro ВЭБ-1 не увеличивает заболеваемость опухолями за счет случаев, ассоциированных с доминирующим типом вируса.
Полный текст
Открыть статью на сайте журналаОб авторах
Владимир Эдуардович Гурцевич
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Автор, ответственный за переписку.
Email: gurtsevitch-vlad-88@yandex.ru
ORCID iD: 0000-0003-1840-4364
д-р мед. наук, профессор, главный научный консультант лаборатории вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Россия, 115478, г. МоскваАлександра Кирилловна Лубенская
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Email: lubenskoy.96@mail.ru
ORCID iD: 0000-0003-3953-7449
научный сотрудник, лаборатория вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Россия, 115478, г. Москва,Наталья Борисовна Сенюта
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Email: nat.senyuta@yandex.ru
ORCID iD: 0000-0001-8915-8274
канд. мед. наук, научный консультант лаборатории вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Россия, 115478, г. МоскваКсения Валерьевна Смирнова
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России; ФГАОУ ВО «Российский университет дружбы народов»; ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
Email: skv.lab@yandex.ru
ORCID iD: 0000-0001-6209-977X
канд. биол. наук, заведующая лабораторией вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, РУДН, ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России
Россия, 115478, г. Москва; 117198, г. Москва; 117997, г. МоскваСписок литературы
- Shannon-Lowe C., Rickinson A. The global landscape of EBV-associated tumors. Front. Oncol. 2019; 9: 713. https://doi.org/10.3389/fonc.2019.00713
- Graham B.S., Lynch D.T. Burkitt Lymphoma. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023.
- Tsao S.W., Tsang C.M., Lo K.W. Epstein-Barr virus infection and nasopharyngeal carcinoma. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2017; 372(1732): 20160270. https://doi.org/10.1098/rstb.2016.0270
- Bei J.X., Zuo X.Y., Liu W.S., Guo Y.M., Zeng Y.X. Genetic susceptibility to the endemic form of NPC. Chin. Clin. Oncol. 2016; 5(2): 15. https://doi.org/10.21037/cco.2016.03.11
- Su W.H., Hildesheim A., Chang Y.S. Human leukocyte antigens and Epstein–Barr virus-associated nasopharyngeal carcinoma: old associations offer new clues into the role of immunity in infection-associated cancers. Front. Oncol. 2013; 3: 299. https://doi.org/10.3389/fonc.2013.00299
- Rickinson A.B., Young L.S., Rowe M. Influence of the Epstein-Barr virus nuclear antigen EBNA 2 on the growth phenotype of virus-transformed B cells. J. Virol. 1987; 61(5): 1310–7. https://doi.org/10.1128/jvi.61.5.1310-1317.1987
- Romero-Masters J.C., Huebner S.M., Ohashi M., Bristol J.A., Benner B.E., Barlow E.A., et al. B cells infected with Type 2 Epstein–Barr virus (EBV) have increased NFATc1/NFATc2 activity and enhanced lytic gene expression in comparison to Type 1 EBV infection. PLoS Pathog. 2020; 16(2): e1008365. https://doi.org/10.1371/journal.ppat.1008365
- Correa R.M., Fellner M.D., Alonio L.V., Durand K., Teyssié A.R., Picconi M.A. Epstein–Barr virus (EBV) in healthy carriers: Distribution of genotypes and 30 bp deletion in latent membrane protein-1 (LMP-1) oncogene. J. Med. Virol. 2004; 73(4): 583–8. https://doi.org/10.1002/jmv.20129
- Srivastava G., Wong K.Y., Chiang A.K., Lam K.Y., Tao Q. Coinfection of multiple strains of Epstein–Barr virus in immunocompetent normal individuals: reassessment of the viral carrier state. Blood. 2000; 95(7): 2443–5.
- Van Baarle D., Hovenkamp E., Kersten M.J., Klein M.R., Miedema F., van Oers M.H. Direct Epstein–Barr virus (EBV) typing on peripheral blood mononuclear cells: no association between EBV type 2 infection or superinfection and the development of acquired immunodeficiency syndrome-related non-Hodgkin’s lymphoma. Blood. 1999; 93(11): 3949–55.
- Sixbey J.W., Shirley P., Chesney P.J., Buntin D.M., Resnick L. Detection of a second widespread strain of Epstein–Barr virus. Lancet. 1989; 2(8666): 761–5. https://doi.org/10.1016/s0140-6736(89)90829-5
- Edwards R.H., Seillier-Moiseiwitsch F., Raab-Traub N. Signature amino acid changes in latent membrane protein 1 distinguish Epstein–Barr virus strains. Virology. 1999; 261(1): 79–95. https://doi.org/10.1006/viro.1999.9855
- Cheung S.T., Leung S.F., Lo K.W., Chiu K.W., Tam J.S., Fok T.F., et al. Specific latent membrane protein 1 gene sequences in type 1 and type 2 Epstein-Barr virus from nasopharyngeal carcinoma in Hong Kong. Int. J. Cancer. 1998; 76(3): 399–406. https://doi.org/10.1002/(sici)1097-0215(19980504)76:3<399::aid-ijc18>3.0.co;2-6
- Oshima M., Azuma H., Okuno A. High prevalence of Epstein-Barr virus type A strain with the 30 b.p. deletion of the latent membrane protein-1 gene in a Japanese population. Pediatr. Int. 1999; 41(5): 490–5. https://doi.org/10.1046/j.1442-200x.1999.01122.x
- Khanim F., Yao Q.Y., Niedobitek G., Sihota S., Rickinson A.B., Young L.S. Analysis of Epstein–Barr virus gene polymorphisms in normal donors and in virus-associated tumors from different geographic locations. Blood. 1996; 88(9): 3491–501.
- Смирнова К.В., Сенюта Н.Б., Ботезату И.В., Душенькина Т.Е., Лубенская А.К., Фроловская А.А. и др. Вирус Эпштейна–Барр у этнических татар: инфицированность и сиквенсные варианты онкогена LMP1. Успехи молекулярной онкологии. 2018; 5(3): 65–74. https://doi.org/10.17650/2313-805X-2018-5-3-65-74 https://elibrary.ru/vloxpu
- Hahn P., Novikova E., Scherback L., Janik C., Pavlish O., Arkhipov V., et al. The LMP1 gene isolated from Russian nasopharyngeal carcinoma has no 30-bp deletion. Int. J. Cancer. 2001; 91(6): 815–21. https://doi.org/10.1002/1097-0215(200002)9999:9999<:aid-ijc1122>3.0.co;2-w
- Hassan R., White L.R., Stefanoff C.G., de Oliveira D.E., Felisbino F.E., Klumb C.E., et al. Epstein–Barr virus (EBV) detection and typing by PCR: a contribution to diagnostic screening of EBV-positive Burkitt’s lymphoma. Diagn. Pathol. 2006; 1: 17. https://doi.org/10.1186/1746-1596-1-17
- Salahuddin S., Khan J., Azhar J., B. Whitehurst C., Qadri I., Shackelford J., et al. Prevalence of Epstein–Barr Virus Genotypes in Pakistani Lymphoma Patients. Asian Pac. J. Cancer Prev. 2018; 19(11): 3153–9. https://doi.org/10.31557/APJCP.2018.19.11.3153
- Каприн А.Д., Старинский В.В., Шахзадова А.О., ред. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.; 2021.
- Young L.S., Yao Q.Y., Rooney C.M., Sculley T.B., Moss D.J., Rupani H., et al. New type B isolates of Epstein–Barr virus from Burkitt’s lymphoma and from normal individuals in endemic areas. J. Gen. Virol. 1987; 68(Pt. 11): 2853–62. https://doi.org/10.1099/0022-1317-68-11-2853
Дополнительные файлы