Seroprevalence of herpes simplex virus type 1 (Herpesviridae: Simplexvirus: Human alphaherpesvirus 1) in smokers
- Authors: Mays J.B.1, Mariem M.N.1, Alabadi H.I.2
-
Affiliations:
- University of Basrah
- Basrah Health Directorate
- Issue: Vol 69, No 2 (2024)
- Pages: 187-192
- Section: SHORT COMMUNICATION
- URL: https://journal-vniispk.ru/0507-4088/article/view/256879
- DOI: https://doi.org/10.36233/0507-4088-220
- EDN: https://elibrary.ru/hcmnwk
- ID: 256879
Cite item
Full Text
Abstract
Introduction. Herpes simplex virus type 1 (HSV-1) is one of the most common human viral infections and has a double-stranded DNA genome belonging to the Herpesviridae family. Smoking is one of the leading causes of disease and premature death worldwide, responsible for the death of up to six million people annually. The purpose of the current study was to determine the seroprevalence of HSV-1 infection among smokers.
Methods. The search strategy was conducted in the period from December 2022 to January 2023. The study included a random sample of 94 (88 males, and 6 females) healthy participants, aged between ≤ 20 to ≥ 60 years, with 50 participants as the control group. The HSV serological testing consisted of detecting antibodies to HSV-1 IgG with the help of ELISA.
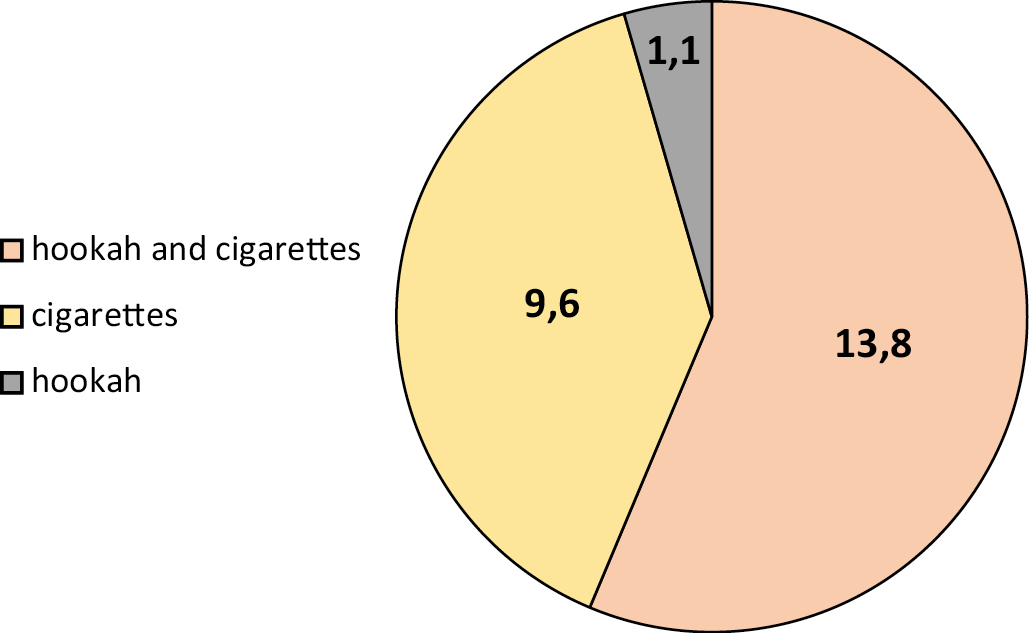
Results. Most participants were university students, consisting of 45.7% males and 5.3% females, followed by employed smokers, consisting of 0.2% males and 1.1% females. The number of females was much lower than that of males reaching 6.4 and 93.6% respectively, due to customs and traditions. The seroprevalence was 24.47, 22.3 and 2.1% in males and females respectively. The seroprevalence rate was 13.8% in hookah and cigarette smokers, 9% in cigarette smokers and 1.1% in hookah smokers exclusively. The highest rate was observed in the age groups of 21-30 and 31–40 years with 12.80% and 7.40% respectively.
Conclusions. The study revealed that the seroprevalence of HSV-1 IgG was 24.47%, and was higher among hookah and cigarette smokers compared to those who exclusively smoked cigarettes or hookah.
Keywords
Full Text
##article.viewOnOriginalSite##About the authors
Jalil B. Mays
University of Basrah
Author for correspondence.
Email: medicalresearch20@yahoo.com
ORCID iD: 0000-0002-4799-0879
Assistant Professor, Principle investigator, Department of Microbiology, College of Medicine
Iraq, BasrahMohammed Ali N. Mariem
University of Basrah
Email: mariem.nbeel@uobasrah.edu.iqea
Assistant lecturer, Investigator, Department of Microbiology, College of Medicine
Iraq, Basrah
Hadi I. Alabadi
Basrah Health Directorate
Email: drhadilazim345@gmail.com
ORCID iD: 0000-0003-7884-1224
Physician, Researcher
Iraq, BasrahReferences
- Kasubi M.J., Nilsen A., Marsden H.S., Bergström T., Langeland N., Haarr L. Prevalence of antibodies against herpes simplex virus types 1 and 2 in children and young people in an urban region in Tanzania. J. Clin. Microbiol. 2006; 44(8): 2801–7. https://doi.org/10.1128/jcm.00180-06
- Arvin A., Campadelli-Fiume G., Mocarski E., Moore P.S., Roizman B., Whitley R., et al. Human Herpesviruses: Biology, Therapy, and Immunoprophylaxis. Cambridge: Cambridge University Press; 2007.
- Looker K.J., Magaret A.S., May M.T., Turner K.M., Vickerman P., Gottlieb S.L., et al. Global and regional estimates of prevalent and incident herpes simplex virus type 1 infections in 2012. PLoS One. 2015; 10(10): e0140765. https://doi.org/10.1371/journal.pone.0140765
- Crimi S., Fiorillo L., Bianchi A., D’Amico C., Amoroso G., Gorassini F., et al. Herpes virus, oral clinical signs and QoL: systematic review of recent data. Viruses. 2019; 11(5): 463. https://doi.org/10.3390/v11050463
- Brady R.C., Bernstein D.I. Treatment of herpes simplex virus infections. Antiviral Res. 2004; 61(2): 73–81. https://doi.org/10.1016/j.antiviral.2003.09.006
- Bernstein D.I., Bellamy A.R., Hook E.W. 3rd, Levin M.J., Wald A., Ewell M.G., et al. Epidemiology, clinical presentation, and antibody response to primary infection with herpes simplex virus type 1 and type 2 in young women. Clin. Infect. Dis. 2013; 56(3): 344–51. https://doi.org/10.1093/cid/cis891
- Albà M.M., Das R., Orengo C.A., Kellam P. Genomewide function conservation and phylogeny in the Herpesviridae. Genome Res. 2001; 11(1): 43–54. https://doi.org/10.1101/gr.149801
- Davison A.J. Herpesvirus systematics. Vet. Microbiol. 2010; 143(1): 52–69. https://doi.org/10.1016/j.vetmic.2010.02.014
- Zmasek C.M., Knipe D.M., Pellett P.E., Scheuermann R.H. Classification of human Herpesviridae proteins using Domain-architecture Aware Inference of Orthologs (DAIO). Virology. 2019; 529: 29–42. https://doi.org/10.1016/j.virol.2019.01.005
- Looker K.J., Garnett G.P. A systematic review of the epidemiology and interaction of herpes simplex virus types 1 and 2. Sex. Transm. Infect. 2005; 81(2): 103–7. https://doi.org/10.1136/sti.2004.012039
- Mark H.D., Nanda J.P., Roberts J., Rompalo A., Melendez J.H., Zenilman J. Performance of focus ELISA tests for HSV-1 and HSV-2 antibodies among university students with no history of genital herpes. Sex. Transm. Dis. 2007; 34(9): 681–5. https://doi.org/10.1097/01.olq.0000258307.18831.f0
- Leung A.K.C., Barankin B. Herpes labialis: an update. Recent Pat. Inflamm. Allergy Drug Discov. 2017; 11(2): 107–13. https://doi.org/10.2174/1872213x11666171003151717
- Fatahzadeh M., Schwartz R.A. Human herpes simplex virus infections: epidemiology, pathogenesis, symptomatology, diagnosis, and management. J. Am. Acad. Dermatol. 2007; 57(5): 737-63; quiz 764-6. https://doi.org/10.1016/j.jaad.2007.06.027
- Vyse A.J., Gay N.J., Slomka M.J., Gopal R., Gibbs T., Morgan-Capner P., et al. The burden of infection with HSV-1 and HSV-2 in England and Wales: implications for the changing epidemiology of genital herpes. Sex. Transm. Infect. 2000; 76(3): 183–7. https://doi.org/10.1136/sti.76.3.183
- Wutzler P., Doerr H.W., Färber I., Eichhorn U., Helbig B., Sauerbrei A., et al. Seroprevalence of herpes simplex virus type 1 and type 2 in selected German populations-relevance for the incidence of genital herpes. J. Med. Virol. 2000; 61(2): 201–7. https://doi.org/10.1002/(sici)1096-9071(200006)61:2%3C201::aid-jmv5%3E3.0.co;2-p
- Aarnisalo J., Ilonen J., Vainionpää R., Volanen I., Kaitosaari T., Simell O. Development of antibodies against cytomegalovirus, varicella-zoster virus and herpes simplex virus in Finland during the first eight years of life: a prospective study. Scand. J. Infect. Dis. 2003; 35(10): 750–3. https://doi.org/10.1080/00365540310015881
- Roberts C.M., Pfister J.R., Spear S.J. Increasing proportion of herpes simplex virus type 1 as a cause of genital herpes infection in college students. Sex. Transm. Dis. 2003; 30(10): 797–800. https://doi.org/10.1097/01.olq.0000092387.58746.c7
- Pebody R.G., Andrews N., Brown D., Gopal R., De Melker H., François G., et al. The seroepidemiology of herpes simplex virus type 1 and 2 in Europe. Sex. Transm. Infect. 2004; 80(3): 185–91. https://doi.org/10.1136/sti.2003.005850
- Xu F., Lee F.K., Morrow R.A., Sternberg M.R., Luther K.E., Dubin G., et al. Seroprevalence of herpes simplex virus type 1 in children in the United States. J. Pediatr. 2007; 151(4): 374–7. https://doi.org/10.1016/j.jpeds.2007.04.065
- Kramer M.A., Uitenbroek D.G., Ujcic-Voortman J.K., Pfrommer C., Spaargaren J., Coutinho R.A., et al. Ethnic differences in HSV1 and HSV2 seroprevalence in Amsterdam, the Netherlands. Euro Surveill. 2008; 13(24): 18904.
- Sauerbrei A., Schmitt S., Scheper T., Brandstädt A., Saschenbrecker S., Motz M., et al., Seroprevalence of herpes simplex virus type 1 and type 2 in Thuringia, Germany, 1999 to 2006. Euro Surveill. 2011; 16(44): 20005.
- Ayoub H.H., Chemaitelly H., Abu-Raddad L.J. Characterizing the transitioning epidemiology of herpes simplex virus type 1 in the USA: model-based predictions. BMC Med. 2019; 17(1): 57. https://doi.org/10.1186/s12916-019-1285-x
- WHO. WHO Report on the Global Tobacco Epidemic, 2011: warning about the dangers of tobacco. Geneva; 2011.
- WHO. WHO Report on the Global Tobacco Epidemic, 2008: the MPOWER package. Geneva; 2008.
- Naame Z.K., Thuwaini M.M., Mahdi D.S. Seroprevalence of (Toxoplasma gondii, CMV, Rubella and HSV1&2) in aborted women in Basra, Southern of Iraq. Ann. Trop. Med. Public Health. 2021; 24(5): 295–301.
- Ohana B., Lipson M., Vered N., Srugo I., Ahdut M., Morag A. Novel approach for specific detection of herpes simplex virus type 1 and 2 antibodies and immunoglobulin G and M antibodies. Clin. Diagn. Lab. Immunol. 2000; 7(6): 904–8. https://doi.org/10.1128/cdli.7.6.904-908.2000
- Nakku-Joloba E., Kambugu F., Wasubire J., Kimeze J., Salata R., Albert J.M., et al. Sero-prevalence of herpes simplex type 2 virus (HSV-2) and HIV infection in Kampala, Uganda. Afr. Health Sci. 2014; 14(4): 782–9. https://doi.org/10.4314/ahs.v14i4.2
- Kalu E. Seroprevalence of herpes simplex virus infections among pregnant women attending antenatal clinic in Benin, Nigeria. Int. J. Trop. Dis. Health. 2014; 4(1): 70–81. https://doi.org/10.9734/IJTDH/2014/6048
- Sukik L., Alyafei M., Harfouche M., Abu-Raddad L.J. Herpes simplex virus type 1 epidemiology in Latin America and the Caribbean: Systematic review and meta-analytics. PLoS One. 2019; 14(4): e0215487. https://doi.org/10.1371/journal.pone.0215487
- Yousuf W., Ibrahim H., Harfouche M., Abu Hijleh F., Abu-Raddad L. Herpes simplex virus type 1 in Europe: systematic review, meta-analyses and meta-regressions. BMJ Glob. Health. 2020; 5(7): e002388. https://doi.org/10.1136/bmjgh-2020-002388
- Fleming D.T., McQuillan G.M., Johnson R.E., Nahmias A.J., Aral S.O., Lee F.K., et al. Herpes simplex virus type 2 in the United States, 1976 to 1994. N. Engl. J. Med. 1997; 337(16): 1105–11. https://doi.org/10.1056/nejm199710163371601
- Debrah O., Agyemang-Yeboah F., Asmah R.H., Timmy-Donkoh E., Seini M.M., Fondjo L.A., et al. SERO-prevalence of herpes simplex virus type 1 and type 2 among women attending routine Cervicare clinics in Ghana. BMC Infect. Dis. 2018; 18(1): 378. https://doi.org/10.1186/s12879-018-3288-1
- Khadr L., Harfouche M., Omori R., Schwarzer G., Chemaitelly H., Abu-Raddad L.J. The epidemiology of herpes simplex virus type 1 in Asia: systematic review, meta-analyses, and meta-regressions. Clin. Infect. Dis. 2019; 68(5): 757–72. https://doi.org/10.1093/cid/ciy562
- Harfouche M., Chemaitelly H., Abu-Raddad L.J. Herpes simplex virus type 1 epidemiology in Africa: Systematic review, meta-analyses, and meta-regressions. J. Infect. 2019; 79(4): 289–99. https://doi.org/10.1016/j.jinf.2019.07.012
- Chaabane S., Harfouche M., Chemaitelly H., Schwarzer G., Abu-Raddad L.J. Herpes simplex virus type 1 epidemiology in the Middle East and North Africa: systematic review, meta-analyses, and meta-regressions. Sci. Rep. 2019; 9(1): 1136. https://doi.org/10.1038/s41598-018-37833-8
Supplementary files