Ultrastructural organization and reproduction of virions in Vero (E6) cells in influenza A/H1N1 pmd09 virus monoinfection and coinfection with SARS-CoV-2 (Delta and Omicron strains)
- Authors: Emtsova K.F.1, Spiridonova E.V.1, Omigov V.V.1, Moiseeva A.A.1, Danilenko E.I.1, Taranov O.S.1
-
Affiliations:
- State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
- Issue: Vol 70, No 3 (2025)
- Pages: 246-253
- Section: ORIGINAL RESEARCHES
- URL: https://journal-vniispk.ru/0507-4088/article/view/310662
- DOI: https://doi.org/10.36233/0507-4088-308
- EDN: https://elibrary.ru/HBLZSL
- ID: 310662
Cite item
Full Text
Abstract
Introduction. RNA-containing viruses, especially influenza viruses, are of high epidemiological significance. The manifestation of COVID-19 has led to the registration of coinfection cases, the pathogenesis of which is poorly studied. The Vero (E6) cell line is widely used to study the morphogenesis of various viruses, including influenza and coronavirus.
The aim of the work is to study the ultrastructure of Vero (E6) cells and the reproduction of viral particles during monoinfection with the influenza A virus and coinfection of this virus with two SARS-CoV-2 genovariants in dynamics 6, 18 and 24 hours after inoculation.
Materials and methods. The Vero (E6) cell line model was used for in vitro study of the viral infection effects and an analysis of the dynamics of changes in the number of intracellular viral particles. The study involved 4 experimental groups: Vero (E6) cells mono-infected with the influenza virus strain A/H1N1 pmd09 at a dose of 0.1 MOI; Vero (E6) cells co-infected with the influenza virus strain A/H1N1 pmd09 and Delta strain of SARS-CoV-2 at a total dose of 0.1 MOI; Vero (E6) cells co-infected with the influenza virus strain A/H1N1 pmd09 and Omicron strain of SARS-CoV-2 at a total dose of 0.1 MOI. In each study group, cells were monitored at time points of 6, 18, and 24 hours.
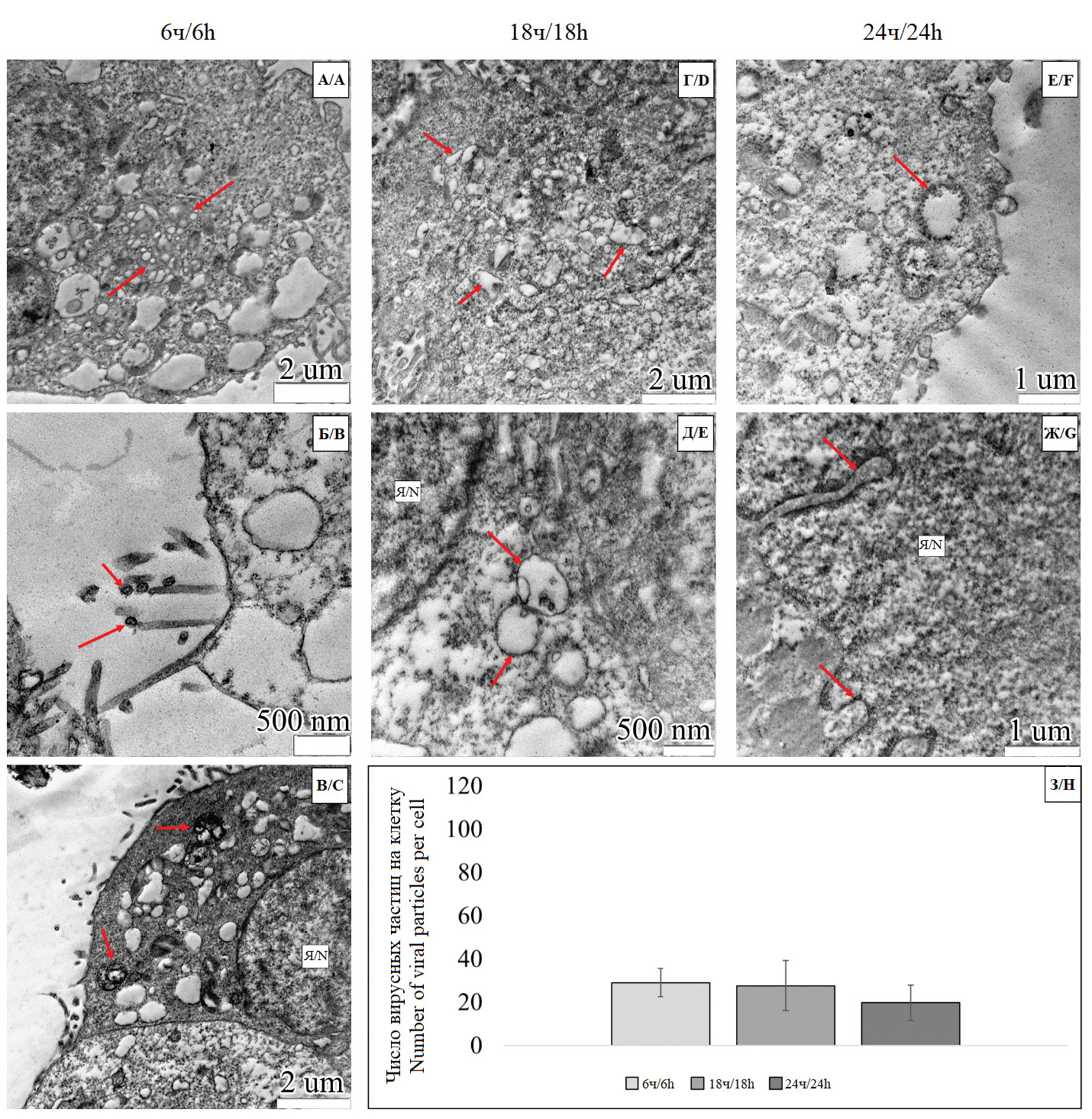
Results. After 6 h, no pathological structures were detected in all groups, except for virus-containing transport vesicles. After 18 h, vacuolization of the ER of varying degree was noted in all the studied groups. After 24 h, ultrastructural changes, namely vacuolization of organelles and/or compaction of the cytoplasm, were encountered in all groups comparatively more frequently than at 6 h and 18 h time points. . The dynamics of the number of viral particles increased significantly by 24 h time point in the monoinfection group. However, none of the coinfection groups demonstrated a tendency for the number of viral particles to change, since no statistically significant differences were found between the 6 h, 18 h, and 24 h stages.
Conclusion. The results obtained suggested that the interaction between A/H1N1 pmd09 and SARS-CoV-2 viruses contributed to an overall decrease in the formation of new virions in Vero (E6) cells in both cases of coinfection.
Keywords
Full Text
##article.viewOnOriginalSite##About the authors
Ksenia F. Emtsova
State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: k.emtsova@g.nsu.ru
ORCID iD: 0009-0003-5165-5357
Trainee Researcher, Department of Microscopic Research
Russian Federation, 630559, Novosibirsk Region, KoltsovoEkaterina V. Spiridonova
State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: spiridonova_ev@vector.nsc.ru
ORCID iD: 0009-0006-8655-6713
Trainee Researcher, Department of Microscopic Research
Russian Federation, 630559, Novosibirsk Region, KoltsovoVladimir V. Omigov
State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Author for correspondence.
Email: omigov_vv@vector.nsc.ru
ORCID iD: 0000-0002-2028-6099
PhD (Medicine), Leading Researcher
Russian Federation, 630559, Novosibirsk Region, KoltsovoAnastasia A. Moiseeva
State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: moiseeva_aa@vector.nsc.ru
ORCID iD: 0000-0001-7048-2357
junior researcher Department of Zoonotic Infections and Influenza
Russian Federation, 630559, Novosibirsk Region, KoltsovoElena I. Danilenko
State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: danilenko_ev@vector.nsc.ru
ORCID iD: 0009-0007-8106-7037
junior researcher Department of Zoonotic Infections and Influenza
Russian Federation, 630559, Novosibirsk Region, KoltsovoOleg S. Taranov
State Scientific Center for Virology and Biotechnology «Vector» of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: taranov@vector.nsc.ru
ORCID iD: 0000-0002-6746-8092
Head of Department of Microscopic Research
Russian Federation, 630559, Novosibirsk Region, KoltsovoReferences
- Matrosovich M.N., Gambaryan A.S., Teneberg S., Piskarev V.E., Yamnikova S.S., Lvov D.K., et al. Avian influenza A viruses differ from human viruses by recognition of sialyloligosaccharides and gangliosides and by a higher conservation of the HA receptor-binding site. Virology. 1997; 233(1): 224–34. https://doi.org/10.1006/viro.1997.8580
- Wu D., Wu T., Liu Q., Yang Z. The SARS-CoV-2 outbreak: What we know. Int. J. Infect. Dis. 2020; 94: 44–8. https://doi.org/10.1016/j.ijid.2020.03.004
- Saito A., Irie T., Suzuki R., Maemura T., Nasser H., Uriu K., et al. Enhanced fusogenicity and pathogenicity of SARS-CoV-2 Delta P681R mutation. Nature. 2022; 602(7896): 300–6. https://doi.org/10.1038/s41586-021-04266-9
- Muik A., Quandt J., Lui B.G., Bacher M., Lutz S., Grünenthal M., et al. Immunity against conserved epitopes dominates after two consecutive exposures to SARS-CoV-2 Omicron BA.1. Cell Rep. 2024; 43(8): 114567. https://doi.org/10.1016/j.celrep.2024.114567
- Wu X., Cai Y., Huang X., Yu X., Zhao L., Wang F., et al. Coinfection with SARS-CoV-2 and influenza A virus in patient with pneumonia, China. Emerg. Infect. Dis. 2020; 26(6): 1324–6. https://doi.org/10.3201/eid2606.200299
- Yue H., Zhang M., Xing L., Wang K., Rao X., Liu H., et al. The epidemiology and clinical characteristics of co-infection of SARS-CoV-2 and influenza viruses in patients during COVID-19 outbreak. J. Med. Virol. 2020; 92(11): 2870–3. https://doi.org/10.1002/jmv.26163.
- Rezaee D., Bakhtiari S., Jalilian F.A., Doosti-Irani A., Asadi F.T., Ansari N. Coinfection with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and influenza virus during the COVID-19 pandemic. Arch. Virol. 2023; 168(2): 53. https://doi.org/10.1007/s00705-022-05628-y
- Nowak M.D., Sordillo E.M., Gitman M.R., Paniz Mondolfi A.E. Coinfection in SARS-CoV-2 infected patients: where are influenza virus and rhinovirus/enterovirus? J. Med. Virol. 2020; 92(10): 1699–700. https://doi.org/10.1002/jmv.25953
- Eymieux S., Rouillé Y., Terrier O., Seron K., Blanchard E., Rosa-Calatrava M., et al. Ultrastructural modifications induced by SARS-CoV-2 in Vero cells: a kinetic analysis of viral factory formation, viral particle morphogenesis and virion release. Cell. Mol. Life Sci. 2021; 78(7): 3565–76. https://doi.org/10.1007/s00018-020-03745-y
- Barreto-Vieira D.F., da Silva M.A.N., Garcia C.C., Miranda M.D., Matos A.D.R., Caetano B.C., et al. Morphology and morphogenesis of SARS-CoV-2 in Vero-E6 cells. Mem. Inst. Oswaldo Cruz. 2021; 116: e200443. https://doi.org/10.1590/0074-02760200443
- Chen P.L., Tzeng T.T., Hu A.Y., Wang L.H., Lee M.S. Development and evaluation of vero cell-derived master donor viruses for influenza pandemic preparedness. Vaccines (Basel). 2020; 8(4):626. https://doi.org/10.3390/vaccines8040626
- Cao Y.C., Deng Q.X., Dai S.X. Remdesivir for severe acute respiratory syndrome coronavirus 2 causing COVID-19: an evaluation of the evidence. Travel Med. Infect. Dis. 2020; 35: 101647. https://doi.org/10.1016/j.tmaid.2020.101647
- Ayari A., Rosa-Calatrava M., Lancel S., Barthelemy J., Pizzorno A., Mayeuf-Louchart A., et al. Influenza infection rewires energy metabolism and induces browning features in adipose cells and tissues. Commun. Biol. 2020; 3(1): 237. https://doi.org/10.1038/s42003-020-0965-6
- Barreto-Vieira D.F., da Silva M.A.N., de Almeida A.L.T., Rasinhas A.D.C., Monteiro M.E., Miranda M.D., et al. SARS-CoV-2: ultrastructural characterization of morphogenesis in an in vitro system. Viruses. 2022; 14(2): 201. https://doi.org/10.3390/v14020201
- Martin A.J., Jans D.A. Antivirals that target the host IMPα/β1-virus interface. Biochem. Soc. Trans. 2021; 49(1): 281–95. https://doi.org/10.1042/bst20200568
Supplementary files