对年龄依赖性脑微血管病患者在不同严重程度认知障碍下的大脑半球皮层表面的形态测量
- 作者: Kremneva E.I.1, Dobrynina L.A.1, Shamtieva K.V.1, Trubitsyna V.V.1, Gadzhieva Z.S.1, Makarova A.G.1, Tsypushtanova M.M.1, Krotenkova M.V.1
-
隶属关系:
- Research Center of Neurology
- 期: 卷 5, 编号 3 (2024)
- 页面: 436-449
- 栏目: 原创性科研成果
- URL: https://journal-vniispk.ru/DD/article/view/310029
- DOI: https://doi.org/10.17816/DD631162
- ID: 310029
如何引用文章
全文:
详细
论证。散发性年龄依赖性脑微血管病占到所有痴呆病例的45%,在评估其认知障碍的基础方面结构性磁共振成像分析发挥着关键作用。在脑微血管病患者中,使用磁共振形态测定法得出的不同结果,需要对其进行广泛的研究,并与临床数据进行比较。
研究目的 — 使用表面形态测量法评估脑微血管病患者认识障碍的大脑萎缩特征
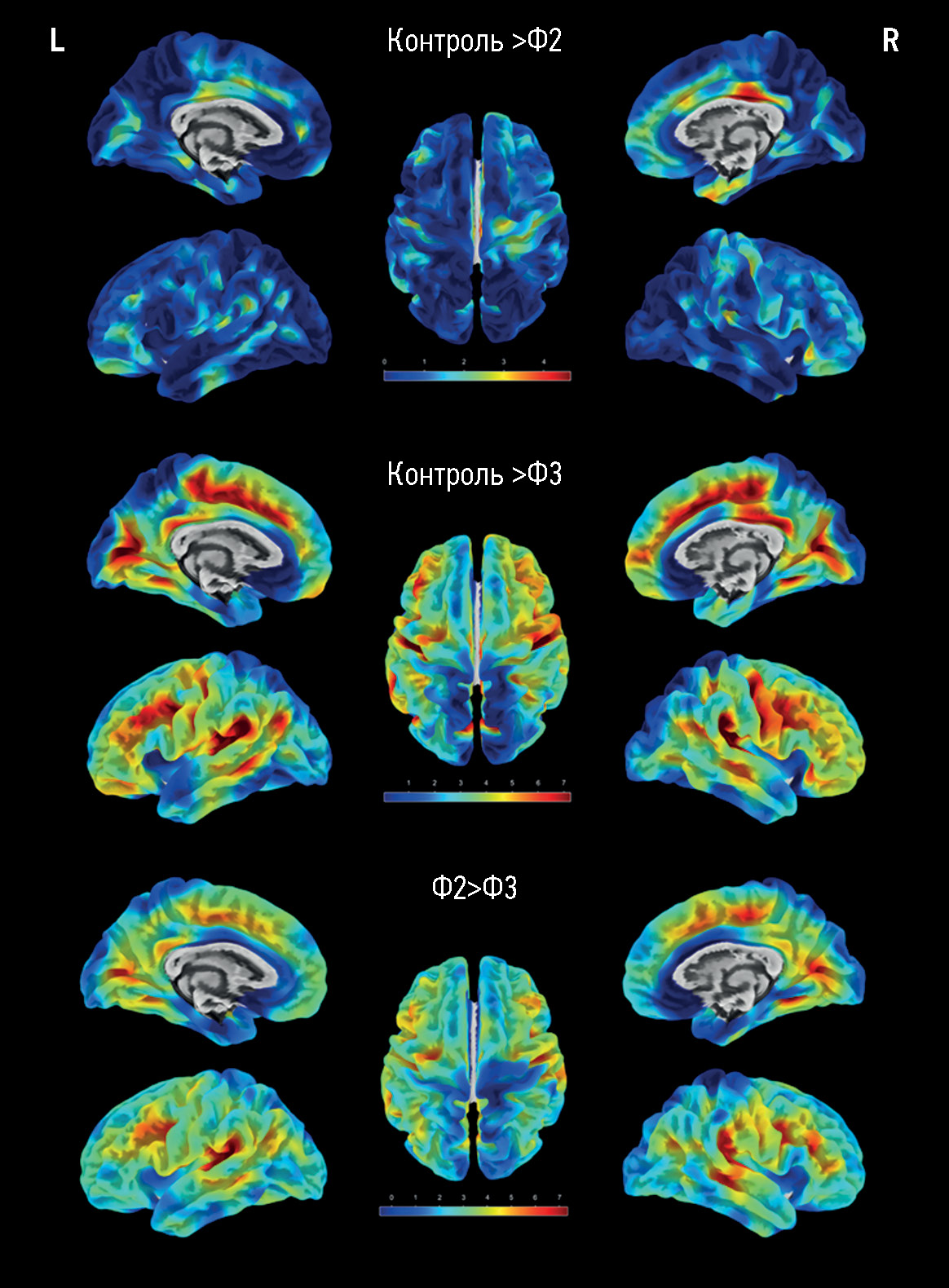
材料和方法。对脑微血管病变和不同严重程度认知障碍(主观、中度和痴呆)的患者,以及一组性别和年龄相当的志愿者进行前瞻性研究和评估。评估包括根据磁共振成像数据分析大脑微血管病的症状,计算大脑微血管病的总指数,并通过表面形态测量法处理 T1mpr图像,对大脑进行总体和区域定量评估,包括大脑半球皮层的厚度。
结果。主要组包括173名脑微血管病患者,对照组包括47名健康的志愿者。随着大脑结构变化和认知障碍的严重表现程度增加,局部区域的皮质厚度也出现了类似的显著下降(p < 0.05),这些区域包括:扣带回,主要是其后部;额叶的内侧和中间部分;岛叶皮质的各个部分;颞顶叶区域(特别是额上回)。脑微血管病患者大脑本身的体积(总体积、灰质和白质体积)仅与对照组有显著差异,而不同认知障碍严重程度的患者组之间则无显著差异。在痴呆与中度认知障碍组、痴呆与主观认知障碍组之间,高密度信号白质体积存在显著差异(P<0.0001)。
结论。在研究期间获得的数据证实,脑微血管病萎缩的继发性/混合性。皮质明显变薄的区域各不相同,这种情况限制了按照萎缩程度来确定大脑微血管病认知障碍的病情发展状态。这使得皮质的定量测量仅作为评估脑微血管病程的预后辅助方法。
作者简介
Elena I. Kremneva
Research Center of Neurology
编辑信件的主要联系方式.
Email: kremneva@neurology.ru
ORCID iD: 0000-0001-9396-6063
SPIN 代码: 8799-8092
MD, Dr. Sci. (Medicine)
俄罗斯联邦, MoscowLarisa A. Dobrynina
Research Center of Neurology
Email: dobrla@mail.ru
ORCID iD: 0000-0001-9929-2725
SPIN 代码: 2824-8750
MD, Dr. Sci. (Medicine), Assistant Professor
俄罗斯联邦, MoscowKamila V. Shamtieva
Research Center of Neurology
Email: kamila.shamt@gmail.com
ORCID iD: 0000-0002-6995-1352
SPIN 代码: 5645-8768
MD, Cand. Sci. (Medicine)
俄罗斯联邦, MoscowVictoria V. Trubitsyna
Research Center of Neurology
Email: pobeda-1994@mail.ru
ORCID iD: 0000-0001-7898-6541
俄罗斯联邦, Moscow
Zukhra S. Gadzhieva
Research Center of Neurology
Email: zuhradoc@mail.ru
ORCID iD: 0000-0001-7498-4063
SPIN 代码: 7015-5970
MD, Cand. Sci. (Medicine)
俄罗斯联邦, MoscowAngelina G. Makarova
Research Center of Neurology
Email: angelinagm@mail.ru
ORCID iD: 0000-0001-8862-654X
MD, Cand. Sci. (Medicine)
俄罗斯联邦, MoscowMaria M. Tsypushtanova
Research Center of Neurology
Email: tzipushtanova@mail.ru
ORCID iD: 0000-0002-4231-3895
MD, Cand. Sci. (Medicine)
俄罗斯联邦, MoscowMarina V. Krotenkova
Research Center of Neurology
Email: krotenkova_mrt@mail.ru
ORCID iD: 0000-0003-3820-4554
SPIN 代码: 9663-8828
MD, Dr. Sci. (Medicine), Assistant Professor
俄罗斯联邦, Moscow参考
- Pantoni L, Gorelick PB. Cerebral small vessel disease. Cambridge University Press; 2014.
- Gorelick PB, Scuteri A, Black SE, et al. Vascular contributions to cognitive impairment and dementia: A statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011;42(9):2672–2713. EDN: PIHATP doi: 10.1161/STR.0b013e3182299496
- Duering M, Biessels GJ, Brodtmann A, et al. Neuroimaging standards for research into small vessel disease-advances since 2013. Lancet Neurol. 2023;22(7):602–618. EDN: AEXCGU doi: 10.1016/S1474-4422(23)00131-X
- Jagust WJ, Zheng L, Harvey DJ, et al. Neuropathological basis of magnetic resonance images in aging and dementia. Ann Neurol. 2008;63(1):72–80. doi: 10.1002/ana.21296
- Godin O, Maillard P, Crivello F, et al. Association of white-matter lesions with brain atrophy markers: The three-city Dijon MRI study. Cerebrovascular Dis. 2009;28(2):177–184. doi: 10.1159/000226117
- Peres R, De Guio F, Chabriat H, et al. Alterations of the cerebral cortex in sporadic small vessel disease: A systematic review of in vivo MRI data. J Cerebral Blood Flow Metabolism. 2016;36(4):681–695. doi: 10.1177/0271678X15625352
- Tuladhar AM, van Norden AG, de Laat KF, et al. White matter integrity in small vessel disease is related to cognition. NeuroImage Clin. 2015;7:518–524. doi: 10.1016/j.nicl.2015.02.003
- Bethlehem RA, Seidlitz J, White SR, et al. Brain charts for the human lifespan. Nature. 2022;604(7906):525–533. EDN: BEAJBV doi: 10.1038/s41586-022-04554-y
- Ashburner J, Friston KJ. Voxel-based morphometry: the methods. Neuroimage. 2000;11(6):805–821. doi: 10.1006/nimg.2000.0582
- Dale AM, Fischl B, Sereno MI. Cortical surface-based analysis. I. Segmentation and surface reconstruction. Neuroimage. 1999;9(2):179–194. doi: 10.1006/nimg.1998.0395
- Goto M, Abe O, Hagiwara A, et al. Advantages of using both voxel-and surface-based morphometry in cortical morphology analysis: A review of various applications. Magnetic Res Med Sci. 2022;21(1):41–57. EDN: VWVUEU doi: 10.2463/mrms.rev.2021-0096
- Damulina AI, Konovalov RN, Kadykov AS. Significance of voxel-based morphometry in studying mild cognitive impairments. Ann Clin Experimental Neurol. 2015;9(3):42–48. EDN: VKPNWD
- Ozzoude M, Ramirez J, Raamana PR, et al. Cortical thickness estimation in individuals with cerebral small vessel disease, focal atrophy, and chronic stroke lesions. Front Neurosci. 2020;14:598868. EDN: QRNNGX doi: 10.3389/fnins.2020.598868
- Mo Y, Huang L, Qin R, et al. Decreased cortical thickness and normal regional homogeneity underlying cognitive impairment in cerebral small vessel disease. Adv Neuro. 2022;1(1):48. doi: 10.36922/an.v1i1.48
- Bookstein FL. “Voxel-based morphometry” should not be used with imperfectly registered images. Neuroimage. 2001;14(6):1454–1462. doi: 10.1006/nimg.2001.0770
- Staals J, Booth T, Morris Z, et al. Total MRI load of cerebral small vessel disease and cognitive ability in older people. Neurobiol Aging. 2015;36(10):2806–2811. doi: 10.1016/j.neurobiolaging.2015.06.024
- Gaser C, Dahnke R, Kurth K, et al. CAT-a computational anatomy toolbox for the analysis of structural MRI data. BioRxiv. 2022. doi: 10.1101/2022.06.11.495736
- Desikan RS, Ségonne F, Fischl B, et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage. 2006;31(3): 968–980. doi: 10.1016/j.neuroimage.2006.01.021
- Smith EE, Beaudin AE. New insights into cerebral small vessel disease and vascular cognitive impairment from MRI. Curr Opinion Neurol. 2018;31(1):36–43. doi: 10.1097/WCO.0000000000000513
- Dobrynina LA, Gadzhieva ZSh, Kremneva EI, et al. Survival, cognitive functions, and brain MRI in patients with cSVD: 5-year observation. Ann Clin Exp Neurol. 2022;16(4):18–28. EDN: EZEIVD doi: 10.54101/ACEN.2022.4.3
- Kremneva EI, Maximov II, Dobrynina LA, Krotenkova MV. The assessment of cerebral white matter microstructure in cerebral small vessel disease based on the diffusion-weighted magnetic resonance imaging. Ann Clin Exp Neurol. 2020;14(1):33–43. EDN: RXKAYI doi: 10.25692/ACEN.2020.1.4
- Gasquoine PG. Localization of function in anterior cingulate cortex: From psychosurgery to functional neuroimaging. Neurosci Biobehavioral Rev. 2013;37(3):340–348. doi: 10.1016/j.neubiorev.2013.01.002
- Dobrynina LA, Gadzhieva ZS, Morozova SN, et al. Executive functions: FMRI of healthy volunteers during stroop test and the serial count test. S.S Korsakov J Neurol Psychiatry. 2018;118(11):64–71. EDN: YRLKTZ doi: 10.17116/jnevro201811811164
- Sergeeva AN, Seliverstova EV, Dobrynina LA, et al. Pulsed arterial spin labeling (pasl) in receiving perfusion and functional data: Technique abilities. Russ Electronic J Radiol. 2019;9(1):148–159. EDN: ZJQHTK doi: 10.21569/2222-7415-2019-9-1-148-159
- Liu R, Wu W, Ye Q, et al. Distinctive and pervasive alterations of functional brain networks in cerebral small vessel disease with and without cognitive impairment. Dementia Geriatric Cognitive Disorders. 2019;47(1-2):55–67. doi: 10.1159/000496455
- Aribisala BS, Hernandez MC, Royle NA, et al. Brain atrophy associations with white matter lesions in the ageing brain: The Lothian birth cohort 1936. Eur Radiol. 2013;23(4):1084–1092. EDN: UYIACD doi: 10.1007/s00330-012-2677-x
- LADIS Study Group. 2001–2011: A decade of the LADIS (Leukoaraiosis and DISability) Study: What have we learned about white matter changes and small-vessel disease? Cerebrovascular Dis. 2011;32(6):577–588. doi: 10.1159/000334498
- Lawrence AJ, Patel B, Morris RG, et al. Mechanisms of cognitive impairment in cerebral small vessel disease: Multimodal MRI results from the St George’s cognition and neuroimaging in stroke (SCANS) study. PloS One. 2013;8(4):e61014. doi: 10.1371/journal.pone.0061014
- Kremneva EI. Age-dependent cerebral microangiopathy: MRI equivalents of cognitive disorders, severity and mechanisms of progression [dissertation]: 3.1.24; 3.1.25. Place of protection: Scientific Centre of Neurology. Moscow; 2023. (In Russ.) Available from: https://neurology.ru/upload/medialibrary/e7e/kas58vctp2as9tqb8pobkp30jztwpbrt/Kremneva-Elena-Igorevna-_-dissertatsiya.pdf. Accessed: 21.04.2024.
- Struyfs H, Sima DM, Wittens M. Automated MRI volumetry as a diagnostic tool for Alzheimer’s disease: Validation of icobrain dm. Neuroimage Clin. 2020;26:102243. doi: 10.1016/j.nicl.2020.102243
- Wonderlick JS, Ziegler DA, Hosseini-Varnamkhasti P, et al. Reliability of MRI-derived cortical and subcortical morphometric measures: Effects of pulse sequence, voxel geometry, and parallel imaging. Neuroimage. 2009;44(4):1324–1333. doi: 10.1016/j.neuroimage.2008.10.037
补充文件