Клинический случай развития симптоматической эпилепсии у новорожденного ребенка с неонатальной гипогликемической энцефалопатией
- Авторы: Мелашенко Т.В.1, Гузева В.В.2, Малеков Д.А.2
-
Учреждения:
- Клиника ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
- ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
- Выпуск: Том 7, № 4 (2016)
- Страницы: 147-152
- Раздел: Статьи
- URL: https://journal-vniispk.ru/pediatr/article/view/5981
- DOI: https://doi.org/10.17816/PED74147-152
- ID: 5981
Цитировать
Полный текст
Аннотация
Полный текст
Симптоматическая эпилепсия у детей раннего возраста — частое неврологическое заболевание этого периода [5]. Одной из причин развития симптоматической эпилепсии у детей раннего возраста может быть неонатальная гипогликемия. Среди метаболических нарушений неонатального периода неонатальная гипогликемия занимает первое место [13]. По данным некоторых исследований, симптоматическая эпилепсия диагностируется у 23–56 % детей с неонатальной гипогликемией в анамнезе [12].
Наиболее характерной формой симптоматической эпилепсии у детей с неонатальной гипогликемией является фокальная затылочная эпилепсия [4]. Сочетание факторов риска, таких как неонатальная гипогликемия и гипоксическая ишемия в неонатальном периоде, увеличивает вероятность возникновения эпилепсии у таких детей [11].
Гипогликемия неонатального периода во многих случаях вызывает повреждение головного мозга у новорожденных детей, развитие неонатальной гипогликемической энцефалопатии (НГЭ). Частота гипогликемических состояний неонатального периода составляет 0,1–0,44 % среди доношенных новорожденных, а по некоторым данным, достигает 15 % [12]. В случаях пролонгированного течения гипогликемии в неонатальном периоде могут развиваться острые и отсроченные неврологические осложнения [4].
Среди основных диагностических критериев НГЭ выделены эпизоды гипогликемии (снижение уровня глюкозы плазмы крови ниже 2,6 ммоль/л) в неонатальном периоде, развитие неврологических нарушений на фоне или после эпизодов гипогликемии и характерные МРТ-паттерны повреждения головного мозга. Исключение других причин развития неврологических нарушений подтверждает гипогликемическую этиологию наблюдаемых нарушений [10].
Клиническая картина НГЭ неспецифична, наиболее часто проявляется изменением поведения младенца, преимущественно выявляется синдром гипервозбудимости центральной нервной системы (ЦНС), в тяжелых случаях отмечается синдром угнетения ЦНС в виде нарушения сознания, выраженной диффузной мышечной гипотонии, угнетения сосательного рефлекса. Судороги развиваются в случаях продолжительного течения гипогликемии, по некоторым данным, при длительности гипогликемии от 12 и более часов [1]. При резком снижении концентрации глюкозы плазмы судороги могут быть первым и единственным клиническим проявлением НГЭ. В неонатальном периоде у детей с НГЭ характерны генерализованные, преимущественно тонико-клонические или клонические приступы. Показано, что при развитии судорог у новорожденных с НГЭ вероятность появления неврологических осложнений в отдаленном периоде возрастает [6]. Также отягощающим фактором развития неврологических осложнений может стать длительное течение гипогликемии (более 10 часов) [3].
Характерные изменения головного мозга у детей с НГЭ могут быть выявлены при проведении магнитно-резонансной томографии (МРТ). Прежде всего отмечаются изменения парието-окципитальной области головного мозга, которые, по данным некоторых исследований, диагностируются через 24 часа после эпизода гипогликемии [2]. Впервые повреждения парието-окципитальных областей головного мозга у новорожденных детей с НГЭ описаны в 1994 году J.A. Spar [14]. В данном исследовании выявлено распространенное истончение коры окципитальных долей больших полушарий. В случаях тяжелого течения НГЭ происходит повреждение субкортикального белого вещества головного мозга (с последующим глиозом), внутренней капсулы (геморрагическое пропитывание) [7].
Патогенез повреждения парието-окципитальных областей больших полушарий головного мозга при НГЭ не вполне ясен. Существует предположение, объясняющее специфическую локализацию церебрального повреждения при НГЭ: выраженная метаболическая церебральная активность парието-окципитальных областей у доношенных новорожденных повышает чувствительность к энергодефициту и, следовательно, является наиболее подверженной повреждающему фактору — гипогликемии [8, 17].
Локализация повреждения головного мозга при неонатальной гипогликемии определяет развитие характерных для НГЭ неврологических осложнений — нарушение коркового зрения, поведения, формирования речи, а также развитие фокальной эпилепсии [9, 15, 16].
Представляем клинический случай развития симптоматической эпилепсии у доношенного ребенка с поздней неонатальной гипогликемической энцефалопатией, осложненной тяжелой гипоксической ишемией.
Клиническое наблюдение
Доношенный мальчик на 22-й день жизни поступил на отделение анестезиологии и реанимации детской кардиохирургии перинатального центра ГБОУ ВПО «СПбГПМУ» в послеоперационном периоде (проведено оперативное лечение врожденного порока сердца — АВ-канал). В анамнезе: ребенок от вторых срочных родов, масса рождения 3450 г, Апгар 7/8 баллов, неврологической симптоматики не выявлено. В отделении реанимации на 2-й день после экстубации у ребенка развилась некорригируемая пролонгированная гипогликемия (минимальные значения концентрации глюкозы плазмы составляли 0,9 ммоль/л). Длительность гипогликемического состояния составила пятнадцать часов. Через десять часов после начала гипогликемии развились генерализованные клонические судороги. В связи с отсутствием терапевтического эффекта противосудорожной терапии (внутривенного болюсного введения седуксена 0,5 %, перорального введения фенобарбитала в нагрузочной дозе 20 мг/кг/сут) ребенок переведен на искусственную вентиляцию легких. Противосудорожная терапия дополнена внутривенным введением конвулекса (10 мг/кг/сут). Купирование судорожных пароксизмов отмечалось через 24 часа после старта терапии препаратом вальпроевой кислоты. Ребенок экстубирован через 2 суток, противосудорожная терапия продолжена пероральной формой конвулекса (15 мг/кг/сут).
Выполнена многоканальная электроэнцефалография (ЭЭГ) с видеозаписью в конце первых суток после начала судорожных пароксизмов. На ЭЭГ регистрируется нерегулярная активность, отмечается депрессия ритма в передних отведениях, в задних отделах периодически встречаются группы заостренных тета-волн с включением единичных спайков (рис. 1).
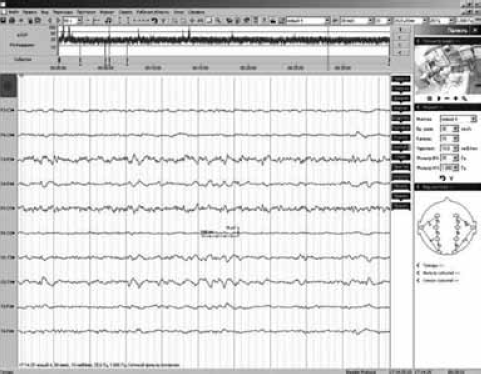
Рис. 1. Электроэнцефалограмма ребенка в конце первых суток после начала судорожных приступов: межприступный период
Зарегистрированы эпилептические приступы, сопровождающиеся низкоамплитудным тремором конечностей с акцентом в правой руке и приоткрыванием глаз с отведением глазных яблок в правую сторону:
- с появлением высокоамплитудных заостренных тета-волн с включением спайков в правых центральных отведениях с последующей генерализацией с акцентом изменений в центральных отделах (регистрируются острые волны, спайки, комплексы острая — медленная волна), с завершением в виде диффузной дельта-активности с включением спайков с акцентом в височных отделах (рис. 2, а, б, в);
- в виде генерализованной заостренной ритмичной активности альфа-диапазона с акцентом в теменно-височных отделах (рис. 3, а, б).
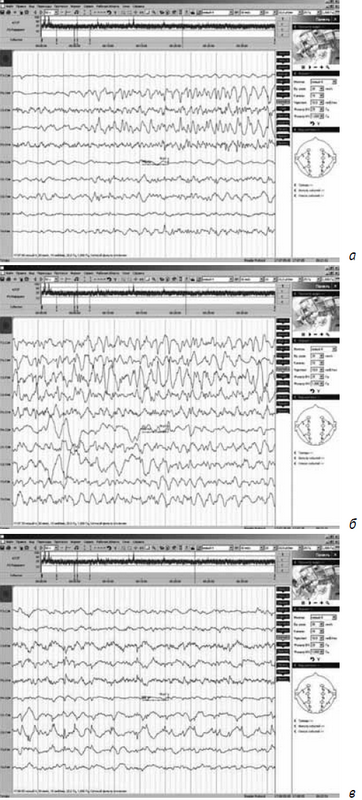
Рис. 2. Электроэнцефалограмма ребенка в конце первых суток после начала судорожных приступов: а) начало приступа; б) продолжение приступа; в) завершение приступа
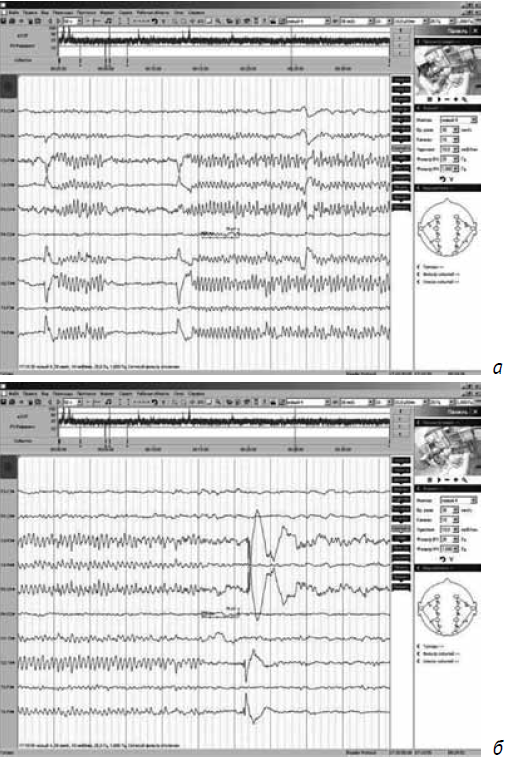
Рис. 3. Электроэнцефалограмма ребенка в конце первых суток после начала судорожных приступов: а) начало приступа; б) конец приступа
Повторная ЭЭГ выполнена на 3-и сутки после начала судорожных приступов. На ЭЭГ регистрируется достаточно регулярная низковольтажная активность, отмечается депрессия ритма в передних отведениях, в задних отделах — низкоамплитудная дельта- и тета-активность с включением спайков (рис. 4).
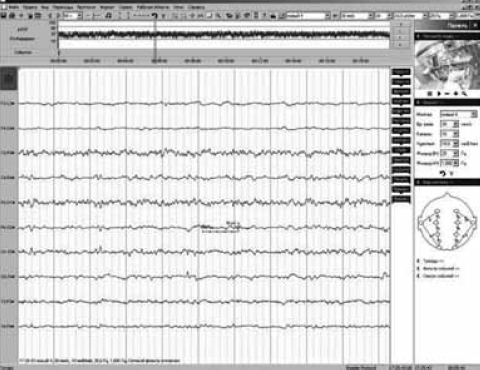
Рис. 4. Электроэнцефалограмма ребенка, выполненная на 3-и сутки после начала судорожных приступов: межприступный период
Зарегистрированы паттерны эпилептических приступов (без какой-либо заметной двигательной активности): с появлением заостренной низкоамплитудной альфа/бета-активности с включением спайков диффузно с акцентом в задних отделах, в последующем с нарастанием амплитуды и увеличением представленности спайков, появлением тета-волн, с завершением в виде диффузной дельта-активности с включением спайков с акцентом в задних отделах, после регистрируется диффузное уплощение активности (рис. 5, а, б, в).
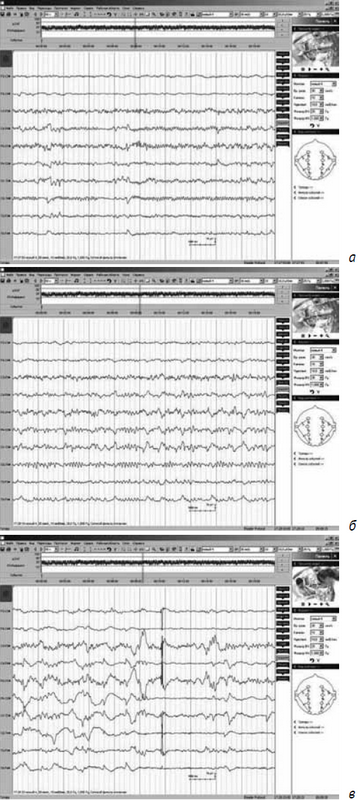
Рис. 5. Электроэнцефалограмма ребенка, выполненная на 3-и сутки после начала судорожных приступов: а) начало приступа; б) середина приступа; в) конец приступа
Выполнена магнитно-резонансная томография (МРТ) головного мозга через 3 недели после первого эпизода судорожных приступов (возраст ребенка на момент проведения исследования 6 недель) на аппарате Philips Ingenia1, 5 T. Получены Т1- Т2-взвешенные изображения, FLAIR-, DWI-изображения. На изображениях МРТ отмечаются зоны диффузных изменений МР-сигнала в теменно-затылочно-височных долях (рис. 6–8) без изменения архитектоники борозд и извилин. На представленных изображениях МРТ в аксиальной плоскости выявляются диффузные атрофические изменения коры головного мозга в затылочных долях, где толщина коры не превышает 1 мм, в сравнении с неизмененной корой в других отделах (рис. 6). На рис. 7 представлены изменения МР-сигнала (FLAIR) от измененной коры в теменно-затылочно-височных долях, без изменения архитектоники извилин. На DWI-картах сохраняются диффузные изменения МР-сигнала от структур затылочных долей, а также более отчетливо видны изменения сигнала от колена мозолистого тела (наконечник стрелки) (рис. 8).
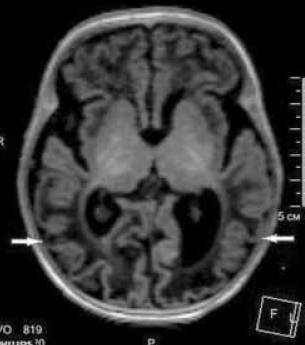
Рис. 6. МРТ головного мозга ребенка в возрасте 6 недель с неонатальной гипогликемической энцефалопатией. Аксиальная плоскость, Т1 ВИ. Стрелками указаны изменения толщины коры головного мозга затылочных долей
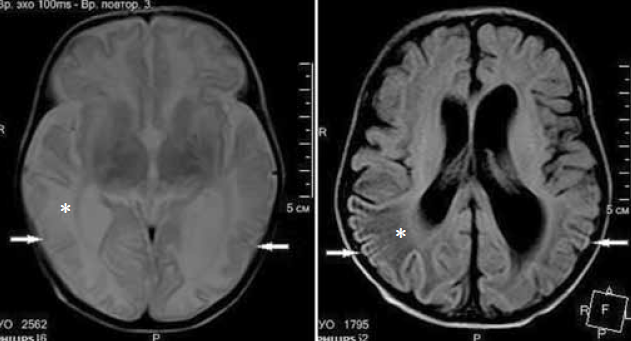
Рис. 7. Аксиальная плоскость по протоколам Т2 и FLAIR соответственно. МРТ головного мозга ребенка в возрасте 6 недель с неонатальной гипогликемической энцефалопатией. Стрелками указаны изменения МР-сигнала от коры в теменно-височно-затылочных областях. Отмеченные звездочкой изменения МР-сигнала в белом веществе соответствуют этапу формирования головного мозга — терминальные зоны миелинизации
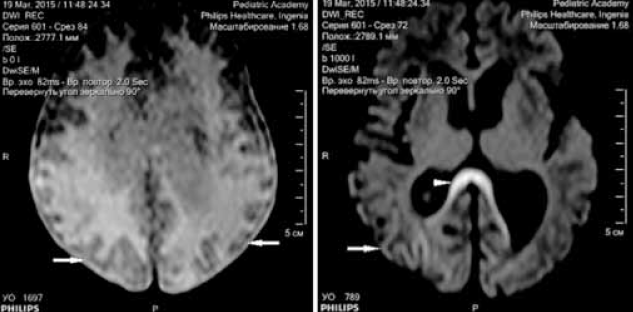
Рис. 8. МРТ головного мозга ребенка в возрасте 6 недель с неонатальной гипогликемической энцефалопатией. Аксиальная плоскость, диффузно-взвешенные изображения (DWI). Стрелками указаны диффузные изменения МР-сигнала от коры головного мозга. Наконечник стрелки указывает на изменения колена мозолистого тела
Заключение
Представленный клинический случай неонатальной гипогликемической энцефалопатии, развившейся у ребенка с перинатальной гипоксической ишемией, осложненной формированием симптоматической эпилепсии, демонстрирует необходимость проведения комплексного обследования с использованием методов нейровизуализации для уточнения этиологии заболевания. МРТ является высокочувствительным методом выявления патологических изменений головного мозга, обусловленных длительной гипогликемией в неонатальном периоде. Отмечена корреляция региональных изменений биоэлектрической активности и структурных повреждений головного мозга, диагностированных МРТ. Иктальная активность у новорожденного ребенка с симптоматической эпилепсией представлена заостренной низкоамплитудной быстрой активностью, спайками с акцентом в задних отделах, диффузная депрессия ритма предшествует и завершает иктальную активность. Представленные данные подтверждают целесообразность выполнения комплексного исследования, включающего МРТ головного мозга и ЭЭГ у новорожденных детей с клиническими судорогами.
Об авторах
Татьяна Владимировна Мелашенко
Клиника ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
Автор, ответственный за переписку.
Email: melashenkotat@mail.ru
канд. мед. наук, врач отделения лучевой диагностики Россия
Виктория Валентиновна Гузева
ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
Email: viktoryka@mail.ru
д-р мед. наук, доцент, кафедра нервных болезней Россия
Дамир Асиятович Малеков
ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
Email: d.a.malekov@gmail.com
ассистент, кафедра медицинской биофизики Россия
Список литературы
- Ayfer Akçay, Sanem Yılmaz, Sarenur Gökben, et al. Neurological and developmental outcome of children with neonatal hypoglycemic seizures. İzmir Dr. Behçet Uz Çocuk Hast. Dergisi. 2014;4(1):37-43.
- Barkovich AJ, Ali FA, Rowley HA, et al. Imaging patterns of neonatal hypoglycemia. AJNR Am J Neuroradiol. 1998;19:523-28.
- Caraballo RH, Sakr D, Mozzi M, et al. Symptomatic occipital lobe epilepsy following neonatal hypoglycemia. Pediatr Neurol. 2004;31:24-29. doi: 10.1016/j.pediatrneurol.2003.12.008.
- Choong Yi Fong, A. Simon Harvey. Variable outcome for epilepsy after neonatal hypoglycaemia. Developmental Medicine & Child Neurology. 2014;56(Is11):1093-1099.
- Clancy Robert R. Summary Proceedings from the Neurology Group on Neonatal Seizures. Pediatrics. 2006;117:23-27.
- Tam EWY, Widjaja E, Blaser SI, et al. Occipital lobe injury and cortical visual outcomes after neonatal gypoglicemia. Pediatrics. 2008;122:507-512. doi: 10.1542/peds.2007-2002.
- Tam EWY, Haeusslein LA, Bonifacio SL, et al. Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy. J Pediatr. 2012;161(1):88-93. doi: 10.1016/j.jpeds.2011.12.047.
- Cowan F. Neonatal Hypoglycemia: Role in Infantile Epilepsy. Indian Pediatrics. 2009;46:122-123.
- Glass HC, Hong KJ, Rogers EE, et al. Risk factors for epilepsy in children with neonatal encephalopathy. Ped Res. 2011;70(5):535-540. doi: 10.1203/PDR.0b013e31822f24c7.
- Jun Su, Li Wang. Research advances in neonatal hypoglycemic brain injury. Transl Pediatr. 2012;1(2):108-115.
- Montassir H, Maegaki Y, Ogura K, et al. Associated factors in neonatal hypoglycemic brain injury. Brain Dev. 2009;3:649-656. doi: 10.1016/j.braindev.2008.10.012.
- Montassir H, Maegaki Y, Ohno K, et al. Long term prognosis of symptomatic occipital lobe epilepsy secondary to neonatal hypoglycemia. Epilepsy Res. 2010;88:93-99. doi: 10.1016/j.eplepsyres.2009.10.001.
- Sood A, Grover M, Sharma R. Biochemical abnormalities in neonatal seizures. Indian J Pediatr. 2003;70:221-4. doi: 10.1007/BF02725588.
- Spar JA, Lewine JD, Orrison WW. Neonatal hypoglycemia: CT and MR findings. AJNR Am J Neuroradiol. 1994;15:1477-78.
- Udani V, Munot P, Ursekar M, et al. Neonatal hypoglycemic brain injury: a common cause of infantile onset remote symptomatic epilepsy. Indian Pediatr. 2009;46:127-32.
- Wong DST, Poskitt KJ, Chau V, et al. Brain Injury Patterns in Hypoglycemia in Neonatal Encephalopathy. AJNR Am J Neuroradiol. 2013;34:1456-61. doi: 10.3174/ajnr.A3423.
- Yalnizoglu D, Haliloglu G, Turanli G, et al. Neurologic outcome in patients with MRI pattern of damage typical for neonatal hypoglycaemia. Brain Dev. 2007;29:285-292. doi: 10.1016/j.braindev.2006.09.011.
Дополнительные файлы







